Aus welchen stoffen bestehen proteine. Aus welchen Elementen bestehen Proteine und welche Eigenschaften haben sie? Monoaminodicarbonsäuren haben eine Amino- und zwei Carboxylgruppen und reagieren in wässriger Lösung sauer.
Der Inhalt des Artikels
PROTEINE (Artikel 1)- eine Klasse biologischer Polymere, die in jedem lebenden Organismus vorhanden sind. Unter Beteiligung von Proteinen finden die Hauptprozesse statt, die die lebenswichtige Aktivität des Körpers sicherstellen: Atmung, Verdauung, Muskelkontraktion, Übertragung von Nervenimpulsen. Knochengewebe, Haut, Haare, Hornformationen von Lebewesen bestehen aus Proteinen. Bei den meisten Säugetieren erfolgt das Wachstum und die Entwicklung des Organismus aufgrund von Produkten, die Proteine als Nahrungsbestandteil enthalten. Die Rolle von Proteinen im Körper und dementsprechend ihre Struktur ist sehr vielfältig.
Die Zusammensetzung von Proteinen.
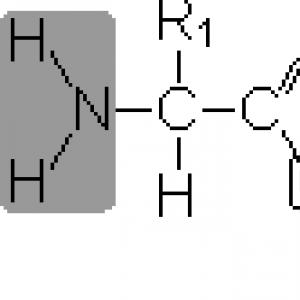
Alle Proteine sind Polymere, deren Ketten aus Aminosäurefragmenten zusammengesetzt sind. Aminosäuren sind organische Verbindungen, die in ihrer Zusammensetzung (dem Namen entsprechend) eine NH 2 -Aminogruppe und eine organische Säure enthalten, d.h. Carboxyl, COOH-Gruppe. Aus der ganzen Vielfalt der existierenden Aminosäuren (theoretisch ist die Zahl der möglichen Aminosäuren unbegrenzt) nehmen nur solche an der Bildung von Proteinen teil, die nur ein Kohlenstoffatom zwischen der Aminogruppe und der Carboxylgruppe haben. Im Allgemeinen können die an der Bildung von Proteinen beteiligten Aminosäuren durch die Formel dargestellt werden: H 2 N–CH(R)–COOH. Die an das Kohlenstoffatom gebundene R-Gruppe (diejenige zwischen den Amino- und Carboxylgruppen) bestimmt den Unterschied zwischen den Aminosäuren, aus denen Proteine bestehen. Diese Gruppe kann nur aus Kohlenstoff- und Wasserstoffatomen bestehen, enthält aber häufiger neben C und H verschiedene funktionelle (zu weiteren Umwandlungen befähigte) Gruppen, z. B. HO-, H 2 N- usw. Es gibt auch eine Option, wenn R \u003d H.
Die Organismen der Lebewesen enthalten mehr als 100 verschiedene Aminosäuren, jedoch werden nicht alle beim Aufbau von Proteinen verwendet, sondern nur 20, die sogenannten „fundamentalen“. Im Tisch. 1 zeigt ihre Namen (die meisten Namen sind historisch gewachsen), die Strukturformel sowie die weit verbreitete Abkürzung. Alle Strukturformeln sind in der Tabelle so angeordnet, dass das Hauptfragment der Aminosäure rechts steht.
| Name | Struktur | Bezeichnung |
| Glycin | GLI | |
| ALANIN | ALA | |
| VALIN | WELLE | |
| LEUCIN | LEI | |
| ISOLEUCIN | ILE | |
| SERIN | SER | |
| THREONIN | TRE | |
| Cystein | GUS | |
| METIONINE | GETROFFEN | |
| LYSIN | LIZ | |
| Arginin | ARG | |
| SPARGELSÄURE | ACH | |
| Spargel | ACH | |
| GLUTAMINSÄURE | GLU | |
| GLUTAMIN | GLN | |
| Phenylalanin | Haartrockner | |
| TYROSIN | TIR | |
| Tryptophan | DREI | |
| HISTIDIN | GIS | |
| PROLIN | PROFI | |
| In der internationalen Praxis wird die abgekürzte Bezeichnung der aufgeführten Aminosäuren mit lateinischen Drei-Buchstaben- oder Ein-Buchstaben-Abkürzungen akzeptiert, zum Beispiel Glycin - Gly oder G, Alanin - Ala oder A. | ||
Von diesen zwanzig Aminosäuren (Tabelle 1) enthält nur Prolin eine NH-Gruppe (statt NH 2 ) neben der COOH-Carboxylgruppe, da es Teil des zyklischen Fragments ist.
Acht Aminosäuren (Valin, Leucin, Isoleucin, Threonin, Methionin, Lysin, Phenylalanin und Tryptophan), die in einer Tabelle auf grauem Hintergrund angeordnet sind, werden als essentiell bezeichnet, da der Körper sie für ein normales Wachstum und eine normale Entwicklung ständig mit Proteinnahrung erhalten muss.
Durch die sequenzielle Verknüpfung von Aminosäuren entsteht ein Proteinmolekül, während die Carboxylgruppe einer Säure mit der Aminogruppe des Nachbarmoleküls interagiert, wodurch eine -CO-NH-Peptidbindung und ein Wasser gebildet werden Molekül wird freigesetzt. Auf Abb. 1 zeigt die Reihenschaltung von Alanin, Valin und Glycin.
Reis. eines SERIELLE VERBINDUNG VON AMINOSÄUREN während der Bildung eines Proteinmoleküls. Als Hauptrichtung der Polymerkette wurde der Weg von der endständigen Aminogruppe H 2 N zur endständigen Carboxylgruppe COOH gewählt.
Um die Struktur eines Proteinmoleküls kompakt zu beschreiben, werden die Abkürzungen für Aminosäuren (Tabelle 1, dritte Spalte) verwendet, die an der Bildung der Polymerkette beteiligt sind. Das Fragment des in Abb. 1 wird wie folgt geschrieben: H 2 N-ALA-VAL-GLY-COOH.
Proteinmoleküle enthalten 50 bis 1500 Aminosäurereste (kürzere Ketten werden als Polypeptide bezeichnet). Die Individualität eines Proteins wird durch den Satz von Aminosäuren bestimmt, aus denen die Polymerkette besteht, und, nicht weniger wichtig, durch die Reihenfolge ihres Wechsels entlang der Kette. Beispielsweise besteht das Insulinmolekül aus 51 Aminosäureresten (es ist eines der Proteine mit der kürzesten Kette) und besteht aus zwei miteinander verbundenen parallelen Ketten ungleicher Länge. Die Sequenz der Aminosäurefragmente ist in Fig. 1 gezeigt. 2.
Reis. 2 INSULIN MOLEKÜL, aufgebaut aus 51 Aminosäureresten, Fragmente gleicher Aminosäuren sind mit der entsprechenden Hintergrundfarbe markiert. Die in der Kette enthaltenen Cystein-Aminosäurereste (Kurzbezeichnung CIS) bilden Disulfidbrücken -S-S-, die zwei Polymermoleküle verbinden, oder Jumper innerhalb einer Kette bilden.
Moleküle der Aminosäure Cystein (Tabelle 1) enthalten reaktive Sulfhydridgruppen -SH, die miteinander wechselwirken und Disulfidbrücken -S-S- bilden. Die Rolle von Cystein in der Welt der Proteine ist eine besondere, mit seiner Beteiligung werden Vernetzungen zwischen polymeren Proteinmolekülen gebildet.
Die Kombination von Aminosäuren zu einer Polymerkette erfolgt in einem lebenden Organismus unter der Kontrolle von Nukleinsäuren. Sie geben eine strenge Montageordnung vor und regulieren die feste Länge des Polymermoleküls ( cm. NUKLEINSÄUREN).
Die Struktur von Proteinen.
Die Zusammensetzung des Proteinmoleküls, dargestellt in Form von abwechselnden Aminosäureresten (Abb. 2), wird als Primärstruktur des Proteins bezeichnet. Zwischen den in der Polymerkette vorhandenen Iminogruppen HN und den Carbonylgruppen CO ( cm. WASSERSTOFFVERBINDUNG) erhält das Proteinmolekül dadurch eine bestimmte räumliche Form, die als Sekundärstruktur bezeichnet wird. Am häufigsten sind zwei Arten von Sekundärstrukturen in Proteinen.
Die erste Option, die als α-Helix bezeichnet wird, wird mithilfe von Wasserstoffbrückenbindungen innerhalb eines Polymermoleküls implementiert. Die geometrischen Parameter des Moleküls, bestimmt durch die Bindungslängen und Bindungswinkel, sind so, dass die Bildung von Wasserstoffbrückenbindungen für die H-N- und C=O-Gruppen möglich ist, zwischen denen sich zwei Peptidfragmente H-N-C=O befinden (Abb. 3) .
Die Zusammensetzung der in Abb. 1 gezeigten Polypeptidkette. 3 wird in abgekürzter Form wie folgt geschrieben:
H 2 N-ALA VAL-ALA-LEY-ALA-ALA-ALA-ALA-VAL-ALA-ALA-ALA-COOH.
Infolge der kontrahierenden Wirkung von Wasserstoffbrückenbindungen nimmt das Molekül die Form einer Helix an - die sogenannte α-Helix, sie wird als gekrümmtes helixförmiges Band dargestellt, das durch die Atome verläuft, die die Polymerkette bilden (Abb. 4).
Reis. vier 3D-MODELL EINES PROTEINMOLEKÜLS in Form einer α-Helix. Wasserstoffbrückenbindungen sind als grün gepunktete Linien dargestellt. Die zylindrische Form der Spirale ist bei einem bestimmten Drehwinkel sichtbar (Wasserstoffatome sind in der Abbildung nicht dargestellt). Die Farbe einzelner Atome wird in Übereinstimmung mit internationalen Regeln angegeben, die Schwarz für Kohlenstoffatome, Blau für Stickstoff, Rot für Sauerstoff und Gelb für Schwefel empfehlen (weiße Farbe wird für Wasserstoffatome empfohlen, die nicht in der Abbildung dargestellt sind, in diesem Fall die gesamte Struktur auf dunklem Hintergrund dargestellt).
Eine andere Variante der Sekundärstruktur, die sogenannte β-Struktur, wird ebenfalls unter Beteiligung von Wasserstoffbrückenbindungen gebildet, der Unterschied besteht darin, dass die H-N- und C=O-Gruppen von zwei oder mehr parallel angeordneten Polymerketten interagieren. Da die Polypeptidkette eine Richtung hat (Abb. 1), sind Varianten möglich, wenn die Richtung der Ketten gleich (parallele β-Struktur, Abb. 5) oder entgegengesetzt ist (antiparallele β-Struktur, Abb. 6). .
An der Bildung der β-Struktur können Polymerketten unterschiedlicher Zusammensetzung beteiligt sein, während die die Polymerkette einrahmenden organischen Gruppen (Ph, CH 2 OH usw.) meist eine untergeordnete Rolle spielen, die gegenseitige Anordnung der H-N und C =O Gruppen ist maßgebend. Da die H-N- und C=O-Gruppen relativ zur Polymerkette in unterschiedliche Richtungen gerichtet sind (nach oben und unten in der Figur), wird es möglich, dass drei oder mehr Ketten gleichzeitig interagieren.
Die Zusammensetzung der ersten Polypeptidkette in Abb. 5:
H 2 N-LEI-ALA-FEN-GLI-ALA-ALA-COOH
Die Zusammensetzung der zweiten und dritten Kette:
H 2 N-GLY-ALA-SER-GLY-TRE-ALA-COOH
Die Zusammensetzung der in Abb. 1 gezeigten Polypeptidketten. 6, das gleiche wie in Abb. 5 besteht der Unterschied darin, dass die zweite Kette die entgegengesetzte (im Vergleich zu 5 ) Richtung hat.
Es ist möglich, innerhalb eines Moleküls eine β-Struktur zu bilden, wenn sich herausstellt, dass das Kettenfragment in einem bestimmten Abschnitt um 180° gedreht ist, in diesem Fall haben zwei Äste eines Moleküls die entgegengesetzte Richtung, folglich eine Antiparallel β-Struktur wird gebildet (Fig. 7).
Die in Abb. 7 in einem flachen Bild, gezeigt in Abb. 8 in Form eines dreidimensionalen Modells. Abschnitte der β-Struktur werden üblicherweise vereinfacht durch ein flaches Wellenband bezeichnet, das durch die Atome verläuft, die die Polymerkette bilden.
In der Struktur vieler Proteine wechseln sich Abschnitte der α-Helix und bandförmige β-Strukturen sowie einzelne Polypeptidketten ab. Ihre gegenseitige Anordnung und Abwechslung in der Polymerkette wird als Tertiärstruktur des Proteins bezeichnet.
Im Folgenden werden Methoden zur Darstellung der Struktur von Proteinen am Beispiel des Pflanzenproteins Crambin aufgezeigt. Strukturformeln von Proteinen, die oft bis zu Hunderte von Aminosäurefragmenten enthalten, sind komplex, umständlich und schwer zu verstehen, daher werden manchmal vereinfachte Strukturformeln verwendet - ohne Symbole chemischer Elemente (Abb. 9, Option A), aber gleichzeitig Zeit behalten sie die Farbe von Valenzstrichen gemäß internationalen Regeln (Abb. 4). In diesem Fall wird die Formel nicht in einem flachen, sondern in einem räumlichen Bild dargestellt, das der realen Struktur des Moleküls entspricht. Mit dieser Methode lassen sich beispielsweise Disulfidbrücken (ähnlich denen im Insulin, Abb. 2), Phenylgruppen im Seitengerüst der Kette usw. unterscheiden. Das Abbild von Molekülen in Form von dreidimensionalen Modellen (Kugeln durch Stäbe verbunden) ist etwas deutlicher (Abb. 9, Option B). Beide Methoden erlauben es jedoch nicht, die Tertiärstruktur darzustellen, daher schlug die amerikanische Biophysikerin Jane Richardson vor, α-Strukturen als spiralförmig verdrillte Bänder (siehe Abb. 4), β-Strukturen als flache wellenförmige Bänder (Abb. 8) und Verbindungen darzustellen sie einzelne Ketten - in Form dünner Bündel hat jede Art von Struktur ihre eigene Farbe. Diese Methode zur Darstellung der Tertiärstruktur eines Proteins ist heute weit verbreitet (Abb. 9, Variante B). Manchmal werden für einen höheren Informationsgehalt eine Tertiärstruktur und eine vereinfachte Strukturformel zusammen dargestellt (Abb. 9, Variante D). Es gibt auch Modifikationen des von Richardson vorgeschlagenen Verfahrens: α-Helices werden als Zylinder dargestellt, und β-Strukturen haben die Form von flachen Pfeilen, die die Richtung der Kette anzeigen (Abb. 9, Option E). Weniger verbreitet ist die Methode, bei der das gesamte Molekül als Bündel dargestellt wird, wobei ungleiche Strukturen durch unterschiedliche Farben unterschieden und Disulfidbrücken als gelbe Brücken dargestellt werden (Abb. 9, Variante E).
Option B ist für die Wahrnehmung am bequemsten, wenn bei der Darstellung der Tertiärstruktur die strukturellen Merkmale des Proteins (Aminosäurefragmente, ihre alternierende Reihenfolge, Wasserstoffbrückenbindungen) nicht angezeigt werden, während angenommen wird, dass alle Proteine „Details“ enthalten. entnommen aus einem Standardsatz von zwanzig Aminosäuren (Tabelle 1). Die Hauptaufgabe bei der Darstellung einer Tertiärstruktur besteht darin, die räumliche Anordnung und den Wechsel von Sekundärstrukturen darzustellen.
Reis. 9 VERSCHIEDENE VERSIONEN VON BILDERN DER STRUKTUR DES CRUMBIN PROTEINS.
A ist eine Strukturformel in einem räumlichen Bild.
B - Struktur in Form eines dreidimensionalen Modells.
B ist die Tertiärstruktur des Moleküls.
G - eine Kombination der Optionen A und B.
E - vereinfachtes Bild der Tertiärstruktur.
E - Tertiärstruktur mit Disulfidbrücken.
Am bequemsten für die Wahrnehmung ist eine dreidimensionale Tertiärstruktur (Option B), befreit von den Details der Strukturformel.
Ein Proteinmolekül mit Tertiärstruktur nimmt in der Regel eine bestimmte Konfiguration an, die durch polare (elektrostatische) Wechselwirkungen und Wasserstoffbrücken gebildet wird. Dadurch nimmt das Molekül die Form einer kompakten Spirale an - globuläre Proteine (Kügelchen, lat. Ball) oder filamentös - fibrilläre Proteine (Fibra, lat. Faser).
Ein Beispiel für eine kugelförmige Struktur ist das Protein Albumin, das Eiweiß eines Hühnereis gehört zur Klasse der Albumine. Die Polymerkette von Albumin besteht hauptsächlich aus Alanin, Asparaginsäure, Glycin und Cystein, die sich in einer bestimmten Reihenfolge abwechseln. Die Tertiärstruktur enthält α-Helices, die durch Einzelketten verbunden sind (Abb. 10).
Reis. zehn GLOBULAR STRUKTUR VON ALBUMIN
Ein Beispiel für eine fibrilläre Struktur ist das Fibroinprotein. Sie enthalten eine große Menge an Glycin-, Alanin- und Serinresten (jeder zweite Aminosäurerest ist Glycin); Sulfhydridgruppen enthaltende Cysteinreste fehlen. Fibroin, der Hauptbestandteil natürlicher Seide und Spinnweben, enthält β-Strukturen, die durch einzelne Ketten verbunden sind (Abb. 11).
Reis. elf FIBRILLÄRES PROTEIN FIBROIN
Die Möglichkeit, eine Tertiärstruktur eines bestimmten Typs zu bilden, ist der Primärstruktur des Proteins inhärent, d.h. vorher durch die Reihenfolge des Wechsels der Aminosäurereste bestimmt. Aus bestimmten Sätzen solcher Reste entstehen überwiegend α-Helices (es gibt ziemlich viele solcher Sätze), ein anderer Satz führt zum Auftreten von β-Strukturen, einzelne Ketten sind durch ihre Zusammensetzung gekennzeichnet.
Einige Proteinmoleküle können sich unter Beibehaltung einer Tertiärstruktur zu großen supramolekularen Aggregaten verbinden, während sie durch polare Wechselwirkungen sowie Wasserstoffbrückenbindungen zusammengehalten werden. Solche Formationen werden als Quartärstruktur des Proteins bezeichnet. Beispielsweise bildet das Protein Ferritin, das hauptsächlich aus Leucin, Glutaminsäure, Asparaginsäure und Histidin besteht (Ferricin enthält alle 20 Aminosäurereste in unterschiedlichen Mengen), eine Tertiärstruktur aus vier parallel gelegten α-Helices. Wenn Moleküle zu einem einzigen Ensemble kombiniert werden (Abb. 12), entsteht eine Quartärstruktur, die bis zu 24 Ferritinmoleküle umfassen kann.
Abb.12 BILDUNG DER QUATERNÄREN STRUKTUR DES GLOBULAREN PROTEINS FERRITIN
Ein weiteres Beispiel für supramolekulare Formationen ist die Struktur von Kollagen. Es ist ein fibrilläres Protein, dessen Ketten hauptsächlich aus Glycin im Wechsel mit Prolin und Lysin aufgebaut sind. Die Struktur enthält Einzelketten, dreifache α-Helices, die sich mit bandartigen β-Strukturen abwechseln, die in parallelen Bündeln gestapelt sind (Abb. 13).
Abb.13 SUPRAMOLEKULARE STRUKTUR VON KOLLAGENFIBRILLÄREM PROTEIN
Chemische Eigenschaften von Proteinen.
Unter Einwirkung von organischen Lösungsmitteln, Abfallprodukten einiger Bakterien (Milchsäuregärung) oder bei Temperaturerhöhung werden Sekundär- und Tertiärstrukturen zerstört, ohne ihre Primärstruktur zu schädigen, dadurch verliert das Protein an Löslichkeit und verliert dadurch an biologischer Aktivität Der Prozess wird als Denaturierung bezeichnet, dh der Verlust natürlicher Eigenschaften, z. B. das Gerinnen von Sauermilch, das geronnene Protein eines gekochten Hühnereis. Bei erhöhten Temperaturen denaturieren die Proteine lebender Organismen (insbesondere Mikroorganismen) schnell. Solche Proteine können nicht an biologischen Prozessen teilnehmen, infolgedessen sterben Mikroorganismen ab, sodass gekochte (oder pasteurisierte) Milch länger gelagert werden kann.
Peptidbindungen H-N-C=O, die die Polymerkette des Proteinmoleküls bilden, werden in Gegenwart von Säuren oder Laugen hydrolysiert und die Polymerkette bricht, was schließlich zu den ursprünglichen Aminosäuren führen kann. Peptidbindungen, die in α-Helices oder β-Strukturen enthalten sind, sind widerstandsfähiger gegen Hydrolyse und verschiedene chemische Angriffe (im Vergleich zu denselben Bindungen in Einzelketten). Eine schonendere Zerlegung des Proteinmoleküls in seine konstituierenden Aminosäuren wird in einem wasserfreien Medium unter Verwendung von Hydrazin H 2 N–NH 2 durchgeführt, während alle Aminosäurefragmente, mit Ausnahme des letzten, die sogenannten Carbonsäurehydrazide bilden das Fragment C (O)-HN-NH 2 ( Abb. 14).
Reis. vierzehn. POLYPEPTID-SPALTUNG
Eine solche Analyse kann Aufschluss über die Aminosäurezusammensetzung eines Proteins geben, wichtiger ist jedoch, deren Abfolge in einem Proteinmolekül zu kennen. Eine der für diesen Zweck weit verbreiteten Methoden ist die Einwirkung von Phenylisothiocyanat (FITC) auf die Polypeptidkette, die sich in einem alkalischen Medium an das Polypeptid anlagert (von dem Ende, das die Aminogruppe enthält), und wenn sich die Reaktion des Mediums ändert zu sauer, löst es sich von der Kette und nimmt ein Fragment einer Aminosäure mit (Abb. 15).
Reis. fünfzehn SEQUENTIELLE POLYPEPTID-Spaltung
Für eine solche Analyse wurden viele spezielle Methoden entwickelt, darunter solche, die beginnen, ein Proteinmolekül ausgehend vom Carboxylende in seine Bestandteile zu „zerlegen“.
Gekreuzte Disulfidbrücken S-S (gebildet durch die Wechselwirkung von Cysteinresten, Abb. 2 und 9) werden gespalten und durch Einwirkung verschiedener Reduktionsmittel in HS-Gruppen umgewandelt. Die Einwirkung von Oxidationsmitteln (Sauerstoff oder Wasserstoffperoxid) führt wiederum zur Bildung von Disulfidbrücken (Abb. 16).
Reis. 16. Spaltung von Disulfidbrücken
Um zusätzliche Quervernetzungen in Proteinen zu schaffen, nutzt man die Reaktivität von Amino- und Carboxylgruppen. Für verschiedene Wechselwirkungen zugänglicher sind die Aminogruppen, die sich im Seitenrahmen der Kette befinden – Fragmente von Lysin, Asparagin, Lysin, Prolin (Tabelle 1). Wenn solche Aminogruppen mit Formaldehyd wechselwirken, findet der Kondensationsprozess statt und es entstehen Kreuzbrücken –NH–CH2–NH– (Abb. 17).
Reis. 17 SCHAFFUNG ZUSÄTZLICHER QUERBRÜCKEN ZWISCHEN PROTEINMOLEKÜLEN.
Die endständigen Carboxylgruppen des Proteins können mit Komplexverbindungen einiger mehrwertiger Metalle (häufiger werden Chromverbindungen verwendet) reagieren, wobei auch Quervernetzungen auftreten. Beide Verfahren werden in der Ledergerbung eingesetzt.
Die Rolle von Proteinen im Körper.
Die Rolle von Proteinen im Körper ist vielfältig.
Enzyme(fermentatio lat. - Fermentation), ihr anderer Name ist Enzyme (en zumh griechisch. - in Hefe) - das sind Proteine mit katalytischer Aktivität, sie können die Geschwindigkeit biochemischer Prozesse um das Tausendfache erhöhen. Unter der Wirkung von Enzymen werden die Bestandteile der Nahrung: Proteine, Fette und Kohlenhydrate in einfachere Verbindungen zerlegt, aus denen dann neue Makromoleküle synthetisiert werden, die für einen bestimmten Körpertyp notwendig sind. Enzyme sind auch an vielen biochemischen Syntheseprozessen beteiligt, beispielsweise an der Synthese von Proteinen (einige Proteine helfen bei der Synthese anderer). Cm. ENZYME
Enzyme sind nicht nur hocheffiziente Katalysatoren, sondern auch selektiv (lenken die Reaktion strikt in die vorgegebene Richtung). In ihrer Gegenwart verläuft die Reaktion mit nahezu 100 %iger Ausbeute ohne die Bildung von Nebenprodukten und gleichzeitig sind die Strömungsbedingungen mild: normaler atmosphärischer Druck und Temperatur eines lebenden Organismus. Zum Vergleich: Die Synthese von Ammoniak aus Wasserstoff und Stickstoff in Gegenwart eines aktivierten Eisenkatalysators wird bei 400–500 °C und einem Druck von 30 MPa durchgeführt, die Ausbeute an Ammoniak beträgt 15–25 % pro Zyklus. Enzyme gelten als unübertroffene Katalysatoren.
Die intensive Erforschung von Enzymen begann Mitte des 19. Jahrhunderts, inzwischen wurden mehr als 2.000 verschiedene Enzyme untersucht, dies ist die vielfältigste Klasse von Proteinen.
Die Namen von Enzymen lauten wie folgt: Der Name des Reagens, mit dem das Enzym interagiert, oder der Name der katalysierten Reaktion wird mit der Endung -aza angehängt, z. B. Arginase zersetzt Arginin (Tabelle 1), Decarboxylase katalysiert Decarboxylierung, d.h. Abspaltung von CO 2 aus der Carboxylgruppe:
– COOH → – CH + CO 2
Um die Rolle eines Enzyms genauer anzugeben, werden häufig sowohl das Objekt als auch die Art der Reaktion in seinem Namen angegeben, zum Beispiel ist Alkoholdehydrogenase ein Enzym, das Alkohole dehydriert.
Für einige vor langer Zeit entdeckte Enzyme hat sich der historische Name (ohne die Endung -aza) erhalten, zum Beispiel Pepsin (pepsis, griechisch. Verdauung) und Trypsin (thrypsis griechisch. Verflüssigung) bauen diese Enzyme Proteine ab.
Zur Systematisierung werden Enzyme zu großen Klassen zusammengefasst, die Klassifizierung basiert auf der Art der Reaktion, die Klassen werden nach dem allgemeinen Prinzip benannt - dem Namen der Reaktion und der Endung - aza. Einige dieser Klassen sind unten aufgeführt.
Oxidoreduktase sind Enzyme, die Redoxreaktionen katalysieren. Die in dieser Klasse enthaltenen Dehydrogenasen führen einen Protonentransfer durch, beispielsweise oxidiert Alkoholdehydrogenase (ADH) Alkohole zu Aldehyden, die anschließende Oxidation von Aldehyden zu Carbonsäuren wird durch Aldehyddehydrogenasen (ALDH) katalysiert. Beide Prozesse laufen im Körper bei der Verarbeitung von Ethanol zu Essigsäure ab (Abb. 18).
Reis. achtzehn ZWEI-STUFEN-OXIDATION VON ETHANOL zu Essigsäure
Nicht Ethanol hat eine narkotische Wirkung, sondern das Zwischenprodukt Acetaldehyd, je geringer die Aktivität des ALDH-Enzyms, desto langsamer verläuft die zweite Stufe - die Oxidation von Acetaldehyd zu Essigsäure - und desto länger und stärker ist die berauschende Wirkung durch die Einnahme von Ethanol. Die Analyse ergab, dass mehr als 80 % der Vertreter der gelben Rasse eine relativ geringe ALDH-Aktivität und damit eine deutlich ausgeprägtere Alkoholtoleranz aufweisen. Der Grund für diese angeborene reduzierte Aktivität von ALDH ist, dass ein Teil der Glutaminsäurereste im „abgeschwächten“ ALDH-Molekül durch Lysinfragmente ersetzt ist (Tabelle 1).
Transferasen- Enzyme, die die Übertragung funktioneller Gruppen katalysieren, beispielsweise katalysiert Transiminase die Übertragung einer Aminogruppe.
Hydrolasen sind Enzyme, die die Hydrolyse katalysieren. Die zuvor erwähnten Trypsin und Pepsine hydrolysieren Peptidbindungen und Lipasen spalten die Esterbindung in Fetten:
–RC(O)OR 1 + H 2 O → –RC(O)OH + HOR 1
Liase- Enzyme, die Reaktionen katalysieren, die auf nicht-hydrolytische Weise stattfinden, als Ergebnis solcher Reaktionen werden C-C-, C-O-, C-N-Bindungen aufgebrochen und neue Bindungen gebildet. Zu dieser Klasse gehört das Enzym Decarboxylase
Isomerasen- Enzyme, die die Isomerisierung katalysieren, z. B. die Umwandlung von Maleinsäure in Fumarsäure (Abb. 19), dies ist ein Beispiel für die cis-trans-Isomerisierung (siehe ISOMERIA).
Reis. 19. ISOMERISIERUNG VON MALEINSÄURE in Gegenwart des Enzyms in Fumarsäure umgewandelt.
Bei der Arbeit von Enzymen wird das allgemeine Prinzip beachtet, wonach immer eine strukturelle Entsprechung zwischen dem Enzym und dem Reagens der beschleunigten Reaktion besteht. Nach dem bildlichen Ausdruck eines der Begründer der Enzymlehre, E. Fisher, nähert sich das Reagenz dem Enzym wie ein Schlüssel zum Schloss. Dabei katalysiert jedes Enzym eine bestimmte chemische Reaktion oder eine Gruppe gleichartiger Reaktionen. Manchmal kann ein Enzym auf eine einzelne Verbindung einwirken, wie Urease (uron griechisch. - Urin) katalysiert nur die Hydrolyse von Harnstoff:
(H 2 N) 2 C \u003d O + H 2 O \u003d CO 2 + 2NH 3
Die feinste Selektivität zeigen Enzyme, die zwischen optisch aktiven Antipoden – links- und rechtshändigen Isomeren – unterscheiden. L-Arginase wirkt nur auf linksdrehendes Arginin und beeinflusst das rechtsdrehende Isomer nicht. L-Lactat-Dehydrogenase wirkt nur auf die linksdrehenden Ester der Milchsäure, die sogenannten Lactate (Lactis lat. Milch), während die D-Lactat-Dehydrogenase nur D-Lactate abbaut.
Die meisten Enzyme wirken nicht auf eine, sondern auf eine Gruppe verwandter Verbindungen, zum Beispiel „bevorzugt“ Trypsin, die von Lysin und Arginin gebildeten Peptidbindungen zu spalten (Tabelle 1).
Die katalytischen Eigenschaften einiger Enzyme, wie z. B. Hydrolasen, werden ausschließlich durch die Struktur des Proteinmoleküls selbst bestimmt, eine andere Klasse von Enzymen – Oxidoreduktasen (z. B. Alkoholdehydrogenase) kann nur in Gegenwart von assoziierten Nichtproteinmolekülen aktiv werden sie - Vitamine, die Mg, Ca, Zn, Mn und Fragmente von Nukleinsäuren aktivieren (Abb. 20).
Reis. zwanzig ALKOHOLD-DEHYDROGENASE-MOLEKÜL
Transportproteine binden und transportieren verschiedene Moleküle oder Ionen durch Zellmembranen (sowohl innerhalb als auch außerhalb der Zelle) sowie von einem Organ zum anderen.
Zum Beispiel bindet Hämoglobin Sauerstoff, wenn Blut durch die Lungen fließt, und gibt ihn an verschiedene Körpergewebe ab, wo Sauerstoff freigesetzt und dann zur Oxidation von Nahrungsbestandteilen verwendet wird, dieser Prozess dient als Energiequelle (manchmal der Begriff „Verbrennen“ von Nahrung in der Nahrung). Körper verwendet wird).
Hämoglobin enthält neben dem Eiweißanteil eine Komplexverbindung von Eisen mit einem zyklischen Porphyrinmolekül (Porphyros griechisch. - lila), die die rote Farbe des Blutes bestimmt. Dieser Komplex (Abb. 21, links) spielt die Rolle eines Sauerstoffträgers. In Hämoglobin befindet sich der Eisen-Porphyrin-Komplex innerhalb des Proteinmoleküls und wird durch polare Wechselwirkungen sowie durch eine koordinative Bindung mit Stickstoff in Histidin (Tabelle 1), das Bestandteil des Proteins ist, festgehalten. Das O2-Molekül, das von Hämoglobin getragen wird, ist über eine koordinative Bindung an das Eisenatom von der Seite angelagert, an der Histidin angelagert ist (Abb. 21, rechts).
Reis. 21 STRUKTUR DES EISENKOMPLEXES
Die Struktur des Komplexes ist rechts in Form eines dreidimensionalen Modells dargestellt. Der Komplex wird im Proteinmolekül durch eine Koordinationsbindung (gestrichelte blaue Linie) zwischen dem Fe-Atom und dem N-Atom im Histidin, das Teil des Proteins ist, gehalten. Das O 2 -Molekül, das von Hämoglobin getragen wird, ist an das Fe-Atom aus dem gegenüberliegenden Land des planaren Komplexes koordiniert (rot gepunktete Linie).
Hämoglobin ist eines der am besten untersuchten Proteine, es besteht aus a-Helices, die durch Einzelketten verbunden sind, und enthält vier Eisenkomplexe. Somit ist Hämoglobin wie ein voluminöses Paket für den Transport von vier Sauerstoffmolekülen auf einmal. Die Form von Hämoglobin entspricht globulären Proteinen (Abb. 22).
Reis. 22 GLOBULAR FORM VON HÄMOGLOBIN
Der wesentliche "Vorteil" des Hämoglobins besteht darin, dass die Anreicherung von Sauerstoff und seine anschließende Abspaltung bei der Übertragung auf verschiedene Gewebe und Organe schnell erfolgt. Kohlenmonoxid, CO (Kohlenmonoxid), bindet noch schneller an Fe im Hämoglobin, bildet aber im Gegensatz zu O 2 einen schwer abbaubaren Komplex. Infolgedessen ist ein solches Hämoglobin nicht in der Lage, O 2 zu binden, was (bei Einatmen großer Mengen Kohlenmonoxid) zum Erstickungstod des Körpers führt.
Die zweite Funktion von Hämoglobin ist die Übertragung von ausgeatmetem CO 2, aber nicht das Eisenatom, sondern das H 2 der N-Gruppe des Proteins ist am Prozess der vorübergehenden Bindung von Kohlendioxid beteiligt.
Die "Leistung" von Proteinen hängt von ihrer Struktur ab, zum Beispiel führt das Ersetzen des einzigen Aminosäurerests der Glutaminsäure in der Hämoglobin-Polypeptidkette durch einen Valinrest (eine selten beobachtete angeborene Anomalie) zu einer Krankheit namens Sichelzellenanämie.
Es gibt auch Transportproteine, die Fette, Glukose und Aminosäuren binden und sowohl innerhalb als auch außerhalb der Zellen transportieren können.
Transportproteine einer besonderen Art transportieren die Stoffe nicht selbst, sondern fungieren als „Transportregler“, indem sie bestimmte Stoffe durch die Membran (die Außenwand der Zelle) leiten. Solche Proteine werden oft als Membranproteine bezeichnet. Sie haben die Form eines Hohlzylinders und sorgen, eingebettet in der Membranwand, für die Bewegung einiger polarer Moleküle oder Ionen in die Zelle. Ein Beispiel für ein Membranprotein ist Porin (Abb. 23).
Reis. 23 PORIN-PROTEIN
Nahrungs- und Speicherproteine dienen, wie der Name schon sagt, als Quellen der inneren Ernährung, häufiger für Embryonen von Pflanzen und Tieren sowie in den frühen Entwicklungsstadien junger Organismen. Zu den Nahrungsproteinen gehören Albumin (Abb. 10) – der Hauptbestandteil von Eiweiß – sowie Casein – das Hauptprotein der Milch. Unter der Wirkung des Enzyms Pepsin gerinnt Casein im Magen, was seine Retention im Verdauungstrakt und eine effiziente Absorption gewährleistet. Casein enthält Fragmente aller vom Körper benötigten Aminosäuren.
In Ferritin (Abb. 12), das im Gewebe von Tieren enthalten ist, werden Eisenionen gespeichert.
Myoglobin ist auch ein Speicherprotein, das in Zusammensetzung und Struktur dem Hämoglobin ähnelt. Myoglobin konzentriert sich hauptsächlich in den Muskeln, seine Hauptaufgabe ist die Speicherung von Sauerstoff, den es durch Hämoglobin erhält. Es wird schnell mit Sauerstoff gesättigt (viel schneller als Hämoglobin) und überträgt es dann allmählich auf verschiedene Gewebe.
Strukturproteine erfüllen eine Schutzfunktion (Haut) oder stützen – sie halten den Körper zusammen und verleihen ihm Festigkeit (Knorpel und Sehnen). Ihr Hauptbestandteil ist das fibrilläre Protein Kollagen (Abb. 11), das häufigste Protein der Tierwelt, im Körper von Säugetieren macht es fast 30 % der gesamten Proteinmasse aus. Kollagen hat eine hohe Zugfestigkeit (die Festigkeit der Haut ist bekannt), aber aufgrund des geringen Gehalts an Quervernetzungen im Hautkollagen sind Tierhäute in ihrer Rohform nicht sehr gut für die Herstellung verschiedener Produkte geeignet. Um das Quellen der Haut in Wasser, das Schrumpfen beim Trocknen sowie das Erhöhen der Festigkeit im gewässerten Zustand und das Erhöhen der Elastizität des Kollagens zu verringern, werden zusätzliche Quervernetzungen geschaffen (Abb. 15a), dies sind die sogenannten Bräunungsprozess der Haut.
In lebenden Organismen werden Kollagenmoleküle, die im Prozess des Wachstums und der Entwicklung des Organismus entstanden sind, nicht aktualisiert und nicht durch neu synthetisierte ersetzt. Mit zunehmendem Alter des Körpers nimmt die Anzahl der Vernetzungen im Kollagen zu, was zu einer Abnahme seiner Elastizität führt, und da keine Erneuerung auftritt, treten altersbedingte Veränderungen auf - eine Zunahme der Zerbrechlichkeit von Knorpel und Sehnen, das Auftreten von Falten auf der Haut.
Gelenkbänder enthalten Elastin, ein Strukturprotein, das sich leicht in zwei Dimensionen dehnen lässt. Die größte Elastizität besitzt das Protein Resilin, das sich bei manchen Insekten an den Scharnierstellen der Flügel befindet.
Hornformationen - Haare, Nägel, Federn, die hauptsächlich aus Keratinprotein bestehen (Abb. 24). Sein Hauptunterschied ist der merkliche Gehalt an Cysteinresten, die Disulfidbrücken bilden, die dem Haar sowie Wollstoffen eine hohe Elastizität (die Fähigkeit, seine ursprüngliche Form nach Verformung wiederherzustellen) verleihen.
Reis. 24. FRAGMENT VON FIBRILLAR PROTEIN KERATIN
Für eine irreversible Formänderung eines Keratinobjekts müssen Sie zuerst die Disulfidbrücken mit Hilfe eines Reduktionsmittels zerstören, ihm eine neue Form geben und dann die Disulfidbrücken mit Hilfe eines Oxidationsmittels wieder herstellen (Abb 16), so wird zum Beispiel Dauerwelle gemacht.
Mit einer Erhöhung des Gehalts an Cysteinresten im Keratin und dementsprechend einer Erhöhung der Anzahl von Disulfidbrücken verschwindet die Verformungsfähigkeit, gleichzeitig tritt jedoch eine hohe Festigkeit auf (bis zu 18% Cysteinfragmente sind in den Hörnern von Huftieren und Schildkrötenpanzern enthalten). Säugetiere haben bis zu 30 verschiedene Arten von Keratin.
Das keratinverwandte fibrilläre Protein Fibroin, das von Seidenraupenraupen beim Einrollen von Kokons sowie von Spinnen beim Weben von Netzen abgesondert wird, enthält nur β-Strukturen, die durch Einzelketten verbunden sind (Abb. 11). Im Gegensatz zu Keratin hat Fibroin keine quer verlaufenden Disulfidbrücken, es hat eine sehr starke Zugfestigkeit (die Festigkeit pro Querschnittseinheit einiger Gewebeproben ist höher als die von Stahlseilen). Aufgrund des Fehlens von Vernetzungen ist Fibroin unelastisch (es ist bekannt, dass Wollstoffe fast unauslöschlich sind und Seidenstoffe leicht knittern).
regulatorische Proteine.
Regulatorische Proteine, häufiger als Hormone bezeichnet, sind an verschiedenen physiologischen Prozessen beteiligt. Beispielsweise besteht das Hormon Insulin (Abb. 25) aus zwei α-Ketten, die durch Disulfidbrücken verbunden sind. Insulin reguliert Stoffwechselprozesse mit Glukose, sein Fehlen führt zu Diabetes.
Reis. 25 PROTEININSULIN
Die Hypophyse des Gehirns synthetisiert ein Hormon, das das Wachstum des Körpers reguliert. Es gibt regulatorische Proteine, die die Biosynthese verschiedener Enzyme im Körper steuern.
Kontraktile und motorische Proteine geben dem Körper die Fähigkeit, sich zusammenzuziehen, seine Form zu verändern und sich zu bewegen, in erster Linie sprechen wir von Muskeln. 40 % der Masse aller in den Muskeln enthaltenen Proteine ist Myosin (mys, myos, griechisch. - Muskel). Sein Molekül enthält sowohl einen fibrillären als auch einen kugelförmigen Teil (Abb. 26).
Reis. 26 MYOSIN-MOLEKÜL
Solche Moleküle verbinden sich zu großen Aggregaten mit 300–400 Molekülen.
Wenn sich die Konzentration von Calciumionen im Raum um die Muskelfasern ändert, tritt eine reversible Änderung der Konformation der Moleküle auf - eine Änderung der Form der Kette aufgrund der Rotation einzelner Fragmente um Valenzbindungen. Dies führt zu Muskelkontraktion und Entspannung, ein Signal für eine Änderung der Konzentration von Calciumionen kommt von den Nervenenden in den Muskelfasern. Künstliche Muskelkontraktion kann durch die Einwirkung elektrischer Impulse verursacht werden, was zu einer starken Änderung der Konzentration von Calciumionen führt. Dies ist die Grundlage für die Stimulierung des Herzmuskels, um die Arbeit des Herzens wiederherzustellen.
Schutzproteine ermöglichen es Ihnen, den Körper vor dem Eindringen angreifender Bakterien, Viren und vor dem Eindringen von Fremdproteinen zu schützen (der allgemeine Name von Fremdkörpern ist Antigene). Die Rolle von Schutzproteinen übernehmen Immunglobuline (ihr anderer Name ist Antikörper), sie erkennen Antigene, die in den Körper eingedrungen sind, und binden fest an sie. Im Körper von Säugetieren, einschließlich Menschen, gibt es fünf Klassen von Immunglobulinen: M, G, A, D und E, ihre Struktur ist, wie der Name schon sagt, kugelförmig, außerdem sind sie alle ähnlich aufgebaut. Die molekulare Organisation von Antikörpern ist unten am Beispiel von Immunglobulin der Klasse G dargestellt (Abb. 27). Das Molekül enthält vier Polypeptidketten, die durch drei S-S-Disulfidbrücken verbunden sind (in Fig. 27 sind sie mit verdickten Valenzbindungen und großen S-Symbolen gezeigt), zusätzlich enthält jede Polymerkette Disulfidbrücken innerhalb der Kette. Zwei große Polymerketten (blau hervorgehoben) enthalten 400–600 Aminosäurereste. Die anderen beiden Ketten (grün hervorgehoben) sind fast halb so lang und enthalten ungefähr 220 Aminosäurereste. Alle vier Ketten sind so angeordnet, dass die endständigen H 2 N-Gruppen in eine Richtung gerichtet sind.
Reis. 27 Schematische Darstellung der Struktur von Immunglobulin
Nachdem der Körper mit einem fremden Protein (Antigen) in Kontakt gekommen ist, beginnen die Zellen des Immunsystems mit der Produktion von Immunglobulinen (Antikörpern), die sich im Blutserum anreichern. In der ersten Stufe leisten Kettenabschnitte mit endständigem H 2 N die Hauptarbeit (in Abb. 27 sind die entsprechenden Abschnitte hellblau und hellgrün markiert). Dies sind Antigen-Capture-Sites. Im Prozess der Immunglobulinsynthese werden diese Stellen so gebildet, dass ihre Struktur und Konfiguration möglichst der Struktur des sich nähernden Antigens entsprechen (wie ein Schlüssel zum Schloss, wie Enzyme, aber die Aufgaben sind in diesem Fall anders). So entsteht für jedes Antigen ein streng individueller Antikörper als Immunantwort. Kein einziges bekanntes Protein kann neben Immunglobulinen seine Struktur in Abhängigkeit von äußeren Faktoren so „plastisch“ verändern. Enzyme lösen das Problem der strukturellen Konformität mit dem Reagenz auf andere Weise - mit Hilfe eines gigantischen Satzes verschiedener Enzyme für alle möglichen Fälle, und Immunglobuline bauen das "Arbeitswerkzeug" jedes Mal neu auf. Darüber hinaus verleiht die Hinge-Region des Immunglobulins (Abb. 27) den beiden Einfangregionen eine gewisse unabhängige Mobilität, wodurch das Immunglobulinmolekül sofort die zwei am besten geeigneten Regionen zum Einfangen im Antigen „finden“ kann, um es sicher zu fixieren it, dies ähnelt den Handlungen eines Krebstiers.
Als nächstes wird eine Kette aufeinanderfolgender Reaktionen des körpereigenen Immunsystems eingeschaltet, Immunglobuline anderer Klassen werden angeschlossen, wodurch das fremde Protein deaktiviert und dann das Antigen (fremder Mikroorganismus oder Toxin) zerstört und entfernt wird.
Nach Kontakt mit dem Antigen wird die maximale Immunglobulinkonzentration (abhängig von der Art des Antigens und den individuellen Eigenschaften des Organismus selbst) innerhalb weniger Stunden (manchmal mehrerer Tage) erreicht. Der Körper behält die Erinnerung an einen solchen Kontakt, und wenn er erneut mit demselben Antigen angegriffen wird, reichern sich Immunglobuline viel schneller und in größeren Mengen im Blutserum an - eine erworbene Immunität tritt auf.
Die obige Klassifizierung von Proteinen ist etwas willkürlich, beispielsweise ist das unter den Schutzproteinen erwähnte Thrombin-Protein im Wesentlichen ein Enzym, das die Hydrolyse von Peptidbindungen katalysiert, dh es gehört zur Klasse der Proteasen.
Schutzproteine werden oft auch als Schlangengiftproteine und die giftigen Proteine mancher Pflanzen bezeichnet, da sie die Aufgabe haben, den Körper vor Schäden zu schützen.
Es gibt Proteine, deren Funktionen so einzigartig sind, dass es schwierig ist, sie zu klassifizieren. Beispielsweise schmeckt das Protein Monellin, das in einer afrikanischen Pflanze vorkommt, sehr süß und wurde als ungiftige Substanz untersucht, die anstelle von Zucker verwendet werden kann, um Fettleibigkeit vorzubeugen. Das Blutplasma einiger antarktischer Fische enthält Proteine mit Frostschutzeigenschaften, die verhindern, dass das Blut dieser Fische gefriert.
Künstliche Synthese von Proteinen.
Die Kondensation von Aminosäuren, die zu einer Polypeptidkette führt, ist ein gut untersuchter Prozess. Es ist beispielsweise möglich, die Kondensation einer beliebigen Aminosäure oder eines Gemisches von Säuren durchzuführen und jeweils ein Polymer zu erhalten, das die gleichen Einheiten oder verschiedene Einheiten enthält, die in zufälliger Reihenfolge alternieren. Solche Polymere haben wenig Ähnlichkeit mit natürlichen Polypeptiden und besitzen keine biologische Aktivität. Die Hauptaufgabe besteht darin, Aminosäuren in einer fest definierten, vorgeplanten Reihenfolge zu verbinden, um die Abfolge von Aminosäureresten in natürlichen Proteinen nachzubilden. Der amerikanische Wissenschaftler Robert Merrifield schlug eine originelle Methode vor, die es ermöglichte, ein solches Problem zu lösen. Die Essenz des Verfahrens besteht darin, dass die erste Aminosäure an ein unlösliches Polymergel gebunden ist, das reaktive Gruppen enthält, die sich mit –COOH-Gruppen der Aminosäure verbinden können. Als solches polymeres Substrat wurde vernetztes Polystyrol mit darin eingeführten Chlormethylgruppen genommen. Damit die zur Reaktion genommene Aminosäure nicht mit sich selbst reagiert und die H 2 N-Gruppe nicht mit dem Substrat verbindet, ist die Aminogruppe dieser Säure mit einem voluminösen Substituenten [(C 4 H 9) 3] 3 OS (O)-Gruppe. Nachdem die Aminosäure an den polymeren Träger gebunden ist, wird die Blockierungsgruppe entfernt und eine andere Aminosäure in das Reaktionsgemisch eingeführt, in der die H 2 N-Gruppe ebenfalls zuvor blockiert ist. In einem solchen System ist nur die Wechselwirkung der H 2 N-Gruppe der ersten Aminosäure und der -COOH-Gruppe der zweiten Säure möglich, die in Gegenwart von Katalysatoren (Phosphoniumsalzen) durchgeführt wird. Dann wird das ganze Schema wiederholt, wobei die dritte Aminosäure eingeführt wird (Abb. 28).
Reis. 28. SYNTHESESCHEMA VON POLYPEPTID-KETTEN
Im letzten Schritt werden die entstandenen Polypeptidketten vom Polystyrolträger getrennt. Jetzt ist der ganze Prozess automatisiert, es gibt automatische Peptid-Synthesizer, die nach dem beschriebenen Schema arbeiten. Viele Peptide, die in Medizin und Landwirtschaft verwendet werden, wurden mit dieser Methode synthetisiert. Es war auch möglich, verbesserte Analoga natürlicher Peptide mit selektiver und verstärkter Wirkung zu erhalten. Einige kleine Proteine wurden synthetisiert, wie das Hormon Insulin und einige Enzyme.
Es gibt auch Methoden der Proteinsynthese, die natürliche Prozesse nachbilden: Fragmente von Nukleinsäuren werden synthetisiert, die so konfiguriert sind, dass sie bestimmte Proteine produzieren, dann werden diese Fragmente in einen lebenden Organismus (z. B. in ein Bakterium) eingefügt, woraufhin der Körper damit beginnt produzieren das gewünschte Protein. Auf diese Weise werden nun erhebliche Mengen an schwer zugänglichen Proteinen und Peptiden sowie deren Analoga gewonnen.
Proteine als Nahrungsquellen.
Proteine in einem lebenden Organismus werden ständig in ihre ursprünglichen Aminosäuren zerlegt (unter unverzichtbarer Beteiligung von Enzymen), einige Aminosäuren gehen in andere über, dann werden Proteine wieder synthetisiert (ebenfalls unter Beteiligung von Enzymen), d.h. der Körper erneuert sich ständig. Einige Proteine (Kollagen der Haut, Haare) werden nicht erneuert, der Körper verliert sie kontinuierlich und synthetisiert stattdessen neue. Proteine als Nahrungsquelle erfüllen zwei Hauptfunktionen: Sie liefern dem Körper Baustoffe für die Synthese neuer Proteinmoleküle und versorgen den Körper zusätzlich mit Energie (Kalorienquellen).
Fleischfressende Säugetiere (einschließlich Menschen) erhalten die notwendigen Proteine aus pflanzlicher und tierischer Nahrung. Keines der aus der Nahrung gewonnenen Proteine wird unverändert in den Körper eingebaut. Im Verdauungstrakt werden alle aufgenommenen Proteine in Aminosäuren zerlegt, und daraus werden bereits für einen bestimmten Organismus notwendige Proteine aufgebaut, während die restlichen 12 aus 8 essentiellen Säuren (Tabelle 1) im Körper synthetisiert werden können, wenn dies nicht der Fall ist in ausreichender Menge mit der Nahrung zugeführt werden, essentielle Säuren müssen jedoch unbedingt mit der Nahrung zugeführt werden. Schwefelatome in Cystein werden vom Körper mit der essentiellen Aminosäure Methionin gewonnen. Ein Teil der Proteine wird abgebaut, wodurch die zur Aufrechterhaltung des Lebens notwendige Energie freigesetzt wird, und der darin enthaltene Stickstoff wird mit dem Urin aus dem Körper ausgeschieden. Normalerweise verliert der menschliche Körper 25–30 g Protein pro Tag, daher müssen proteinreiche Lebensmittel immer in der richtigen Menge vorhanden sein. Der tägliche Mindestbedarf an Protein beträgt 37 g für Männer und 29 g für Frauen, die empfohlene Zufuhr ist jedoch fast doppelt so hoch. Bei der Bewertung von Lebensmitteln ist es wichtig, die Proteinqualität zu berücksichtigen. Bei Fehlen oder geringem Gehalt an essentiellen Aminosäuren gilt das Protein als geringwertig, daher sollten solche Proteine in größeren Mengen verzehrt werden. So enthalten die Proteine von Hülsenfrüchten wenig Methionin und die Proteine von Weizen und Mais sind arm an Lysin (beide Aminosäuren sind essentiell). Tierische Proteine (ausgenommen Kollagene) werden als vollwertige Lebensmittel eingestuft. Ein vollständiger Satz aller essentiellen Säuren enthält Milchkasein, sowie Hüttenkäse und daraus zubereiteten Käse, also eine vegetarische Ernährung, wenn sie sehr streng ist, d.h. „milchfrei“ erfordert einen erhöhten Verzehr von Hülsenfrüchten, Nüssen und Pilzen, um den Körper mit essentiellen Aminosäuren in der richtigen Menge zu versorgen.
Synthetische Aminosäuren und Proteine werden auch als Lebensmittelprodukte verwendet, indem sie Futtermitteln zugesetzt werden, die essentielle Aminosäuren in geringen Mengen enthalten. Es gibt Bakterien, die Ölkohlenwasserstoffe verarbeiten und assimilieren können, in diesem Fall müssen sie für die vollständige Synthese von Proteinen mit stickstoffhaltigen Verbindungen (Ammoniak oder Nitrate) gefüttert werden. Das so gewonnene Eiweiß wird als Futtermittel für Vieh und Geflügel verwendet. Tierfutter wird oft eine Reihe von Enzymen, Kohlenhydrate, zugesetzt, die die Hydrolyse von schwer abbaubaren Kohlenhydrat-Nahrungsbestandteilen (Zellwände von Getreide) katalysieren, wodurch pflanzliche Nahrung besser absorbiert wird.
Michail Levitsky
PROTEINE (Artikel 2)
(Proteine), eine Klasse komplexer stickstoffhaltiger Verbindungen, die charakteristischsten und wichtigsten (neben Nukleinsäuren) Bestandteile lebender Materie. Proteine erfüllen viele und vielfältige Funktionen. Die meisten Proteine sind Enzyme, die chemische Reaktionen katalysieren. Auch viele Hormone, die physiologische Prozesse regulieren, sind Proteine. Strukturproteine wie Kollagen und Keratin sind die Hauptbestandteile von Knochengewebe, Haaren und Nägeln. Die kontraktilen Proteine der Muskeln haben die Fähigkeit, ihre Länge zu ändern, indem sie chemische Energie verwenden, um mechanische Arbeit zu leisten. Proteine sind Antikörper, die Giftstoffe binden und neutralisieren. Einige Proteine, die auf äußere Einflüsse (Licht, Geruch) reagieren können, dienen als Rezeptoren in den Sinnesorganen, die Reizungen wahrnehmen. Viele Proteine, die sich innerhalb der Zelle und auf der Zellmembran befinden, erfüllen regulatorische Funktionen.
In der ersten Hälfte des 19. Jahrhunderts Viele Chemiker, darunter vor allem J. von Liebig, kamen nach und nach zu dem Schluss, dass Proteine eine besondere Klasse stickstoffhaltiger Verbindungen sind. Der Name "Proteine" (vom griechischen protos - der erste) wurde 1840 vom niederländischen Chemiker G. Mulder vorgeschlagen.
PHYSIKALISCHE EIGENSCHAFTEN
Proteine sind im festen Zustand weiß, in Lösung jedoch farblos, es sei denn, sie tragen eine chromophore (farbige) Gruppe wie Hämoglobin. Die Wasserlöslichkeit verschiedener Proteine ist sehr unterschiedlich. Sie variiert auch mit dem pH-Wert und mit der Konzentration von Salzen in der Lösung, so dass man die Bedingungen wählen kann, unter denen ein Protein selektiv in Gegenwart anderer Proteine ausfällt. Dieses "Aussalzen"-Verfahren wird weithin verwendet, um Proteine zu isolieren und zu reinigen. Das gereinigte Protein fällt oft als Kristalle aus der Lösung aus.
Im Vergleich zu anderen Verbindungen ist das Molekulargewicht von Proteinen sehr groß - von mehreren Tausend bis zu vielen Millionen Dalton. Daher werden während der Ultrazentrifugation Proteine ausgefällt, und zwar mit unterschiedlichen Raten. Aufgrund des Vorhandenseins von positiv und negativ geladenen Gruppen in Proteinmolekülen bewegen sie sich in einem elektrischen Feld mit unterschiedlichen Geschwindigkeiten. Dies ist die Grundlage der Elektrophorese, einer Methode zur Isolierung einzelner Proteine aus komplexen Gemischen. Die Aufreinigung von Proteinen erfolgt ebenfalls durch Chromatographie.
CHEMISCHE EIGENSCHAFTEN
Struktur.
Proteine sind Polymere, d.h. Moleküle, die wie Ketten aus sich wiederholenden Monomereinheiten oder Untereinheiten aufgebaut sind, deren Rolle von Alpha-Aminosäuren gespielt wird. Allgemeine Formel von Aminosäuren
wobei R ein Wasserstoffatom oder eine organische Gruppe ist.
Ein Proteinmolekül (Polypeptidkette) kann aus nur einer relativ geringen Anzahl von Aminosäuren oder mehreren tausend Monomereinheiten bestehen. Die Verbindung von Aminosäuren in der Kette ist möglich, weil jede von ihnen zwei verschiedene chemische Gruppen hat: eine basische Aminogruppe, NH2, und eine saure Carboxylgruppe, COOH. Beide dieser Gruppen sind an das a-Kohlenstoffatom gebunden. Die Carboxylgruppe einer Aminosäure kann mit der Aminogruppe einer anderen Aminosäure eine Amid- (Peptid-) Bindung eingehen:
Nachdem zwei Aminosäuren auf diese Weise verbunden wurden, kann die Kette verlängert werden, indem an die zweite Aminosäure eine dritte hinzugefügt wird, und so weiter. Wie aus der obigen Gleichung ersichtlich ist, wird bei der Bildung einer Peptidbindung ein Wassermolekül freigesetzt. In Gegenwart von Säuren, Laugen oder proteolytischen Enzymen verläuft die Reaktion in umgekehrter Richtung: Die Polypeptidkette wird unter Zugabe von Wasser in Aminosäuren gespalten. Diese Reaktion nennt man Hydrolyse. Die Hydrolyse verläuft spontan, und es wird Energie benötigt, um Aminosäuren zu einer Polypeptidkette zu verbinden.
Eine Carboxylgruppe und eine Amidgruppe (oder eine ihr ähnliche Imidgruppe - im Fall der Prolinaminosäure) sind in allen Aminosäuren vorhanden, während die Unterschiede zwischen Aminosäuren durch die Art dieser Gruppe oder "Seite" bestimmt werden -Kette", die oben durch den Buchstaben R angezeigt wird. Die Rolle der Seitenkette kann von einem Wasserstoffatom, wie der Aminosäure Glycin, und einigen voluminösen Gruppierungen, wie Histidin und Tryptophan, gespielt werden. Einige Seitenketten sind chemisch inert, während andere hoch reaktiv sind.
Viele tausend verschiedene Aminosäuren können synthetisiert werden, und viele verschiedene Aminosäuren kommen in der Natur vor, aber nur 20 Arten von Aminosäuren werden für die Proteinsynthese verwendet: Alanin, Arginin, Asparagin, Asparaginsäure, Valin, Histidin, Glycin, Glutamin, Glutaminsäure Säure, Isoleucin, Leucin, Lysin, Methionin, Prolin, Serin, Tyrosin, Threonin, Tryptophan, Phenylalanin und Cystein (in Proteinen kann Cystein als Dimer vorliegen - Cystin). Es stimmt, dass es in einigen Proteinen zusätzlich zu den regelmäßig vorkommenden zwanzig weitere Aminosäuren gibt, aber sie werden als Ergebnis der Modifikation einer der zwanzig aufgelisteten gebildet, nachdem sie in das Protein aufgenommen wurde.
optische Aktivität.
Alle Aminosäuren, mit Ausnahme von Glycin, haben vier verschiedene Gruppen, die an das α-Kohlenstoffatom gebunden sind. In Bezug auf die Geometrie können vier verschiedene Gruppen auf zwei Arten angehängt werden, und dementsprechend gibt es zwei mögliche Konfigurationen oder zwei Isomere, die sich wie ein Objekt zu ihrem Spiegelbild beziehen, d.h. wie von links nach rechts. Eine Konfiguration wird als links oder linkshändig (L) und die andere als rechtshändig oder rechtshändig (D) bezeichnet, da sich die beiden solchen Isomere in der Rotationsrichtung der Ebene des polarisierten Lichts unterscheiden. In Proteinen kommen nur L-Aminosäuren vor (Ausnahme Glycin; es kann nur in einer Form dargestellt werden, da zwei seiner vier Gruppen gleich sind) und alle haben optische Aktivität (da es nur ein Isomer gibt). D-Aminosäuren sind in der Natur selten; Sie kommen in einigen Antibiotika und in der Zellwand von Bakterien vor.
Die Sequenz der Aminosäuren.
Aminosäuren in der Polypeptidkette sind nicht zufällig angeordnet, sondern in einer bestimmten festen Reihenfolge, und diese Reihenfolge bestimmt die Funktionen und Eigenschaften des Proteins. Durch Variieren der Reihenfolge der 20 Arten von Aminosäuren erhält man eine Vielzahl unterschiedlicher Proteine, genauso wie man aus den Buchstaben des Alphabets viele verschiedene Texte bilden kann.
Früher dauerte die Bestimmung der Aminosäuresequenz eines Proteins oft mehrere Jahre. Die direkte Bestimmung ist immer noch eine ziemlich mühselige Aufgabe, obwohl Geräte geschaffen wurden, die es ermöglichen, sie automatisch durchzuführen. Meist ist es einfacher, die Nukleotidsequenz des entsprechenden Gens zu bestimmen und daraus die Aminosäuresequenz des Proteins abzuleiten. Bis heute wurden bereits die Aminosäuresequenzen von vielen hundert Proteinen bestimmt. Die Funktionen entschlüsselter Proteine sind in der Regel bekannt, was dazu beiträgt, sich die möglichen Funktionen ähnlicher Proteine vorzustellen, die beispielsweise in bösartigen Neubildungen gebildet werden.
Komplexe Proteine.
Proteine, die nur aus Aminosäuren bestehen, werden als einfach bezeichnet. Oft ist jedoch ein Metallatom oder eine chemische Verbindung, die keine Aminosäure ist, an die Polypeptidkette gebunden. Solche Proteine werden komplex genannt. Ein Beispiel ist Hämoglobin: Es enthält Eisenporphyrin, das ihm seine rote Farbe verleiht und es ihm ermöglicht, als Sauerstoffträger zu fungieren.
Die Namen der meisten komplexen Proteine enthalten einen Hinweis auf die Art der angehängten Gruppen: Zucker sind in Glykoproteinen vorhanden, Fette in Lipoproteinen. Wenn die katalytische Aktivität des Enzyms von der angehängten Gruppe abhängt, spricht man von einer prosthetischen Gruppe. Oft spielt ein Vitamin die Rolle einer prothetischen Gruppe oder ist Teil davon. Vitamin A beispielsweise, das an eines der Proteine der Netzhaut gebunden ist, bestimmt deren Lichtempfindlichkeit.
Tertiärstruktur.
Wichtig ist nicht so sehr die Aminosäuresequenz des Proteins (Primärstruktur), sondern die Art und Weise, wie es räumlich verlegt ist. Entlang der gesamten Länge der Polypeptidkette bilden Wasserstoffionen regelmäßige Wasserstoffbrückenbindungen, die ihr die Form einer Spirale oder Schicht verleihen (Sekundärstruktur). Aus der Kombination solcher Helices und Schichten entsteht eine kompakte Form der nächsten Ordnung - die Tertiärstruktur des Proteins. Um die Bindungen herum, die die monomeren Glieder der Kette halten, sind Drehungen um kleine Winkel möglich. Aus rein geometrischer Sicht ist daher die Zahl der möglichen Konfigurationen für jede Polypeptidkette unendlich groß. In Wirklichkeit existiert jedes Protein normalerweise nur in einer Konfiguration, die durch seine Aminosäuresequenz bestimmt wird. Diese Struktur ist nicht starr, sie scheint zu "atmen" - sie oszilliert um eine bestimmte Durchschnittskonfiguration. Die Kette wird in eine Konfiguration gefaltet, in der die freie Energie (die Fähigkeit, Arbeit zu verrichten) minimal ist, genau wie eine entspannte Feder nur auf einen Zustand zusammengedrückt wird, der einem Minimum an freier Energie entspricht. Oft ist ein Teil der Kette durch Disulfidbindungen (–S–S–) zwischen zwei Cysteinresten fest mit dem anderen verbunden. Unter anderem deshalb spielt Cystein unter den Aminosäuren eine besonders wichtige Rolle.
Die Komplexität der Struktur von Proteinen ist so groß, dass es noch nicht möglich ist, die Tertiärstruktur eines Proteins zu berechnen, selbst wenn seine Aminosäuresequenz bekannt ist. Aber wenn es möglich ist, Proteinkristalle zu erhalten, dann kann ihre Tertiärstruktur durch Röntgenbeugung bestimmt werden.
Bei strukturellen, kontraktilen und einigen anderen Proteinen sind die Ketten verlängert und mehrere leicht gefaltete Ketten, die nebeneinander liegen, bilden Fibrillen; Fibrillen wiederum falten sich zu größeren Formationen - Fasern. Die meisten Proteine in Lösung sind jedoch kugelförmig: Die Ketten sind in einem Kügelchen aufgerollt, wie Garn in einem Knäuel. Die freie Energie in dieser Konfiguration ist minimal, da die hydrophoben („wasserabstoßenden“) Aminosäuren im Inneren des Kügelchens verborgen sind, während sich die hydrophilen („wasseranziehenden“) Aminosäuren auf seiner Oberfläche befinden.
Viele Proteine sind Komplexe aus mehreren Polypeptidketten. Diese Struktur wird Quartärstruktur des Proteins genannt. Das Hämoglobin-Molekül zum Beispiel besteht aus vier Untereinheiten, von denen jede ein globuläres Protein ist.
Strukturproteine bilden aufgrund ihrer linearen Konfiguration Fasern, bei denen die Zugfestigkeit sehr hoch ist, während die globuläre Konfiguration es Proteinen ermöglicht, spezifische Wechselwirkungen mit anderen Verbindungen einzugehen. Auf der Oberfläche des Kügelchens erscheint bei richtiger Anordnung der Ketten eine bestimmte Form von Hohlraum, in dem sich reaktive chemische Gruppen befinden. Wenn dieses Protein ein Enzym ist, dann dringt ein anderes, normalerweise kleineres Molekül irgendeiner Substanz in einen solchen Hohlraum ein, so wie ein Schlüssel in ein Schloss eintritt; in diesem Fall ändert sich die Konfiguration der Elektronenwolke des Moleküls unter dem Einfluss von chemischen Gruppen, die sich in der Kavität befinden, und dies zwingt es zu einer bestimmten Reaktion. Auf diese Weise katalysiert das Enzym die Reaktion. Auch Antikörpermoleküle haben Hohlräume, in denen verschiedene Fremdstoffe binden und dadurch unschädlich gemacht werden. Das "Schlüssel-und-Schloss"-Modell, das die Wechselwirkung von Proteinen mit anderen Verbindungen erklärt, ermöglicht es, die Spezifität von Enzymen und Antikörpern zu verstehen, d.h. ihre Fähigkeit, nur mit bestimmten Verbindungen zu reagieren.
Proteine in verschiedenen Arten von Organismen.
Proteine, die in verschiedenen Pflanzen- und Tierarten die gleiche Funktion erfüllen und daher den gleichen Namen tragen, haben auch eine ähnliche Konfiguration. Sie unterscheiden sich jedoch etwas in ihrer Aminosäuresequenz. Wenn Arten von einem gemeinsamen Vorfahren abweichen, werden einige Aminosäuren an bestimmten Positionen durch Mutationen durch andere ersetzt. Schädliche Mutationen, die Erbkrankheiten verursachen, werden durch natürliche Selektion verworfen, aber nützliche oder zumindest neutrale können erhalten bleiben. Je näher zwei biologische Arten beieinander liegen, desto weniger Unterschiede gibt es in ihren Proteinen.
Einige Proteine verändern sich relativ schnell, andere sind recht konservativ. Zu letzteren gehört beispielsweise Cytochrom c, ein Atmungsenzym, das in den meisten lebenden Organismen vorkommt. Bei Menschen und Schimpansen sind seine Aminosäuresequenzen identisch, während sich beim Cytochrom c des Weizens nur 38 % der Aminosäuren als unterschiedlich herausstellten. Auch beim Vergleich von Mensch und Bakterien sind die Ähnlichkeiten von Cytochromen mit (die Unterschiede betreffen hier 65 % der Aminosäuren) noch erkennbar, obwohl der gemeinsame Vorfahre von Bakterien und Menschen vor etwa zwei Milliarden Jahren auf der Erde lebte. Heutzutage wird der Vergleich von Aminosäuresequenzen häufig verwendet, um einen phylogenetischen (genealogischen) Baum zu erstellen, der die evolutionären Beziehungen zwischen verschiedenen Organismen widerspiegelt.
Denaturierung.
Das synthetisierte Proteinmolekül, die Faltung, erhält seine eigene Konfiguration. Diese Konfiguration kann jedoch durch Erhitzen, durch Ändern des pH-Werts, durch Einwirkung organischer Lösungsmittel und sogar durch einfaches Rühren der Lösung zerstört werden, bis Blasen auf ihrer Oberfläche erscheinen. Ein derart verändertes Protein nennt man denaturiert; es verliert seine biologische Aktivität und wird normalerweise unlöslich. Bekannte Beispiele für denaturiertes Protein sind gekochte Eier oder Schlagsahne. Kleine Proteine, die nur etwa hundert Aminosäuren enthalten, sind in der Lage zu renaturieren, d.h. die ursprüngliche Konfiguration wiederherstellen. Aber die meisten Proteine werden einfach in eine Masse verknäulter Polypeptidketten umgewandelt und stellen ihre vorherige Konfiguration nicht wieder her.
Eine der Hauptschwierigkeiten bei der Isolierung aktiver Proteine ist ihre extreme Empfindlichkeit gegenüber Denaturierung. Diese Eigenschaft von Proteinen findet nützliche Anwendung bei der Konservierung von Lebensmitteln: Hohe Temperaturen denaturieren irreversibel die Enzyme von Mikroorganismen, und die Mikroorganismen sterben ab.
PROTEINSYNTHESE
Für die Proteinsynthese muss ein lebender Organismus über ein Enzymsystem verfügen, das in der Lage ist, eine Aminosäure an eine andere zu binden. Es wird auch eine Informationsquelle benötigt, die bestimmt, welche Aminosäuren verbunden werden sollten. Da es im Körper tausende Arten von Proteinen gibt und jede von ihnen im Durchschnitt aus mehreren hundert Aminosäuren besteht, müssen die erforderlichen Informationen wirklich enorm sein. Es wird (ähnlich wie eine Aufzeichnung auf einem Magnetband) in den Nukleinsäuremolekülen gespeichert, aus denen die Gene bestehen.
Enzymaktivierung.
Eine aus Aminosäuren synthetisierte Polypeptidkette ist nicht immer ein Protein in seiner endgültigen Form. Viele Enzyme werden zunächst als inaktive Vorstufen synthetisiert und werden erst aktiv, nachdem ein anderes Enzym einige Aminosäuren von einem Ende der Kette entfernt hat. Einige der Verdauungsenzyme wie Trypsin werden in dieser inaktiven Form synthetisiert; diese Enzyme werden im Verdauungstrakt durch die Entfernung des Endstücks der Kette aktiviert. Das Hormon Insulin, dessen Molekül in seiner aktiven Form aus zwei kurzen Ketten besteht, wird in Form einer einzigen Kette synthetisiert, der sogenannten. Proinsulin. Dann wird der mittlere Teil dieser Kette entfernt und die verbleibenden Fragmente binden aneinander und bilden das aktive Hormonmolekül. Komplexe Proteine werden erst gebildet, nachdem eine bestimmte chemische Gruppe an das Protein gebunden wurde, und diese Bindung erfordert oft auch ein Enzym.
Stoffwechselkreislauf.
Nachdem ein Tier mit Aminosäuren gefüttert wurde, die mit radioaktiven Isotopen von Kohlenstoff, Stickstoff oder Wasserstoff markiert sind, wird die Markierung schnell in seine Proteine eingebaut. Wenn markierte Aminosäuren nicht mehr in den Körper gelangen, beginnt die Menge der Markierung in Proteinen abzunehmen. Diese Experimente zeigen, dass die entstehenden Proteine nicht bis zum Lebensende im Körper gespeichert werden. Mit wenigen Ausnahmen befinden sich alle in einem dynamischen Zustand, in dem sie ständig zu Aminosäuren zerfallen und dann neu synthetisiert werden.
Einige Proteine werden beim Absterben von Zellen abgebaut und zerstört. Dies geschieht beispielsweise ständig, wenn rote Blutkörperchen und Epithelzellen die innere Oberfläche des Darms auskleiden. Darüber hinaus finden der Abbau und die Neusynthese von Proteinen auch in lebenden Zellen statt. Seltsamerweise ist über den Abbau von Proteinen weniger bekannt als über ihre Synthese. Klar ist aber, dass am Abbau proteolytische Enzyme beteiligt sind, ähnlich denen, die im Verdauungstrakt Proteine in Aminosäuren spalten.
Die Halbwertszeit verschiedener Proteine ist unterschiedlich - von mehreren Stunden bis zu vielen Monaten. Die einzige Ausnahme sind Kollagenmoleküle. Einmal gebildet, bleiben sie stabil und werden nicht erneuert oder ersetzt. Im Laufe der Zeit ändern sich jedoch einige ihrer Eigenschaften, insbesondere die Elastizität, und da sie nicht erneuert werden, sind gewisse altersbedingte Veränderungen, wie das Auftreten von Falten auf der Haut, die Folge.
synthetische Proteine.
Chemiker haben schon lange gelernt, Aminosäuren zu polymerisieren, aber die Aminosäuren werden willkürlich kombiniert, so dass die Produkte einer solchen Polymerisation wenig Ähnlichkeit mit natürlichen haben. Es ist zwar möglich, Aminosäuren in einer bestimmten Reihenfolge zu kombinieren, was es ermöglicht, einige biologisch aktive Proteine, insbesondere Insulin, zu erhalten. Das Verfahren ist ziemlich kompliziert, und auf diese Weise können nur solche Proteine gewonnen werden, deren Moleküle etwa hundert Aminosäuren enthalten. Es ist stattdessen bevorzugt, die Nukleotidsequenz eines Gens zu synthetisieren oder zu isolieren, das der gewünschten Aminosäuresequenz entspricht, und dieses Gen dann in ein Bakterium einzuführen, das durch Replikation eine große Menge des gewünschten Produkts produziert. Diese Methode hat jedoch auch ihre Nachteile.
PROTEINE UND ERNÄHRUNG
Wenn Proteine im Körper in Aminosäuren zerlegt werden, können diese Aminosäuren für die Proteinsynthese wiederverwendet werden. Gleichzeitig unterliegen die Aminosäuren selbst einem Zerfall, sodass sie nicht vollständig verwertet werden. Es ist auch klar, dass während des Wachstums, der Schwangerschaft und der Wundheilung die Proteinsynthese den Abbau übersteigen muss. Der Körper verliert kontinuierlich einige Proteine; dies sind die Proteine von Haaren, Nägeln und der Oberflächenschicht der Haut. Daher muss jeder Organismus für die Synthese von Proteinen Aminosäuren aus der Nahrung erhalten.
Quellen von Aminosäuren.
Grüne Pflanzen synthetisieren alle 20 in Proteinen vorkommenden Aminosäuren aus CO2, Wasser und Ammoniak oder Nitraten. Viele Bakterien sind auch in der Lage, Aminosäuren in Gegenwart von Zucker (oder einem Äquivalent) und festem Stickstoff zu synthetisieren, aber Zucker wird letztendlich von grünen Pflanzen geliefert. Bei Tieren ist die Fähigkeit, Aminosäuren zu synthetisieren, begrenzt; Sie erhalten Aminosäuren, indem sie grüne Pflanzen oder andere Tiere essen. Im Verdauungstrakt werden die aufgenommenen Proteine in Aminosäuren zerlegt, diese resorbiert und daraus die für den jeweiligen Organismus charakteristischen Proteine aufgebaut. Keines der absorbierten Proteine wird als solches in Körperstrukturen eingebaut. Die einzige Ausnahme besteht darin, dass bei vielen Säugetieren ein Teil der mütterlichen Antikörper intakt durch die Plazenta in den fötalen Kreislauf gelangen und durch die Muttermilch (insbesondere bei Wiederkäuern) unmittelbar nach der Geburt auf das Neugeborene übertragen werden kann.
Bedarf an Proteinen.
Es ist klar, dass der Körper zur Aufrechterhaltung des Lebens eine bestimmte Menge an Protein aus der Nahrung erhalten muss. Die Höhe dieses Bedarfs hängt jedoch von einer Reihe von Faktoren ab. Der Körper benötigt Nahrung sowohl als Energiequelle (Kalorien) als auch als Material zum Aufbau seiner Strukturen. An erster Stelle steht der Energiebedarf. Das bedeutet, dass Nahrungsproteine bei wenig Kohlenhydraten und Fetten in der Nahrung nicht für die Synthese ihrer eigenen Proteine, sondern als Kalorienquelle verwendet werden. Bei längerem Fasten werden sogar Ihre eigenen Proteine verbraucht, um den Energiebedarf zu decken. Wenn die Nahrung genügend Kohlenhydrate enthält, kann die Proteinaufnahme reduziert werden.
Stickstoffbilanz.
Durchschnittlich ca. 16 % der gesamten Proteinmasse sind Stickstoff. Wenn die Aminosäuren, aus denen Proteine bestehen, abgebaut werden, wird der darin enthaltene Stickstoff in Form verschiedener stickstoffhaltiger Verbindungen mit dem Urin und (in geringerem Maße) mit dem Kot aus dem Körper ausgeschieden. Daher ist es zweckmäßig, einen solchen Indikator wie die Stickstoffbilanz zu verwenden, um die Qualität der Proteinernährung zu beurteilen, d.h. die Differenz (in Gramm) zwischen der Stickstoffmenge, die dem Körper zugeführt wird, und der Stickstoffmenge, die pro Tag ausgeschieden wird. Bei normaler Ernährung eines Erwachsenen sind diese Mengen gleich. In einem wachsenden Organismus ist die Menge des ausgeschiedenen Stickstoffs geringer als die Menge des zugeführten, d. h. die Bilanz ist positiv. Bei einem Mangel an Protein in der Ernährung ist die Bilanz negativ. Wenn die Nahrung genügend Kalorien enthält, die Proteine jedoch vollständig fehlen, speichert der Körper Proteine. Gleichzeitig verlangsamt sich der Proteinstoffwechsel und die Wiederverwertung von Aminosäuren in der Proteinsynthese läuft so effizient wie möglich ab. Verluste sind jedoch unvermeidlich, und stickstoffhaltige Verbindungen werden weiterhin mit dem Urin und teilweise mit dem Kot ausgeschieden. Als Maß für den täglichen Eiweißmangel kann die Menge an Stickstoff dienen, die der Körper pro Tag während des Eiweißmangels ausscheidet. Es liegt auf der Hand, anzunehmen, dass es möglich ist, das Stickstoffgleichgewicht wiederherzustellen, indem man eine diesem Mangel entsprechende Proteinmenge in die Nahrung einführt. Dies ist jedoch nicht der Fall. Nachdem der Körper diese Menge an Protein erhalten hat, beginnt er, Aminosäuren weniger effizient zu verwenden, sodass etwas zusätzliches Protein erforderlich ist, um das Stickstoffgleichgewicht wiederherzustellen.
Wenn die Proteinmenge in der Nahrung das zur Aufrechterhaltung des Stickstoffgleichgewichts erforderliche Maß übersteigt, scheint dies keinen Schaden zu verursachen. Überschüssige Aminosäuren werden einfach als Energiequelle genutzt. Ein besonders auffälliges Beispiel sind die Eskimos, die wenig Kohlenhydrate und etwa zehnmal mehr Protein zu sich nehmen, als zur Aufrechterhaltung des Stickstoffgleichgewichts erforderlich ist. In den meisten Fällen ist die Verwendung von Protein als Energiequelle jedoch nicht vorteilhaft, da Sie aus einer bestimmten Menge Kohlenhydrate viel mehr Kalorien gewinnen können als aus der gleichen Menge Protein. In armen Ländern erhält die Bevölkerung die notwendigen Kalorien aus Kohlenhydraten und nimmt ein Minimum an Eiweiß zu sich.
Wenn der Körper die erforderliche Anzahl an Kalorien in Form von Nicht-Eiweiß-Nahrung erhält, beträgt die Mindestmenge an Protein, die das Stickstoffgleichgewicht aufrechterhält, ca. 30 Gramm pro Tag. Etwa so viel Eiweiß steckt in vier Scheiben Brot oder 0,5 Liter Milch. Eine etwas größere Menge wird normalerweise als optimal angesehen; empfohlen von 50 bis 70 g.
Essentielle Aminosäuren.
Bisher wurde Protein als Ganzes betrachtet. Damit die Proteinsynthese stattfinden kann, müssen alle notwendigen Aminosäuren im Körper vorhanden sein. Einige der Aminosäuren kann der Körper des Tieres selbst synthetisieren. Sie werden als austauschbar bezeichnet, da sie nicht in der Nahrung enthalten sein müssen, wichtig ist nur, dass im Allgemeinen die Zufuhr von Protein als Stickstoffquelle ausreichend ist; Bei einem Mangel an nicht-essentiellen Aminosäuren kann der Körper diese dann auf Kosten der im Überschuss vorhandenen synthetisieren. Die restlichen „essentiellen“ Aminosäuren können nicht synthetisiert werden und müssen mit der Nahrung aufgenommen werden. Essentiell für den Menschen sind Valin, Leucin, Isoleucin, Threonin, Methionin, Phenylalanin, Tryptophan, Histidin, Lysin und Arginin. (Obwohl Arginin im Körper synthetisiert werden kann, wird es als essentielle Aminosäure angesehen, da Neugeborene und heranwachsende Kinder unzureichende Mengen davon produzieren. Andererseits ist für eine Person im reifen Alter die Aufnahme einiger dieser Aminosäuren über die Nahrung erforderlich kann optional werden.)
Diese Liste essentieller Aminosäuren ist bei anderen Wirbeltieren und sogar bei Insekten ungefähr gleich. Der Nährwert von Proteinen wird normalerweise bestimmt, indem man sie an wachsende Ratten verfüttert und die Gewichtszunahme der Tiere überwacht.
Der Nährwert von Proteinen.
Der Nährwert eines Proteins wird durch die essentielle Aminosäure bestimmt, die am meisten fehlt. Lassen Sie uns dies an einem Beispiel veranschaulichen. Die Proteine unseres Körpers enthalten durchschnittlich ca. 2% Tryptophan (nach Gewicht). Nehmen wir an, dass die Ernährung 10 g Protein enthält, das 1 % Tryptophan enthält, und dass es genügend andere essentielle Aminosäuren enthält. In unserem Fall entsprechen 10 g dieses defekten Proteins im Wesentlichen 5 g eines vollständigen Proteins; die restlichen 5 g können nur als Energiequelle dienen. Beachten Sie, dass, da Aminosäuren praktisch nicht im Körper gespeichert werden und alle Aminosäuren gleichzeitig vorhanden sein müssen, damit die Proteinsynthese stattfinden kann, die Wirkung der Einnahme von essentiellen Aminosäuren nur festgestellt werden kann, wenn alle von ihnen in den Körper gelangen Körper gleichzeitig.
Die durchschnittliche Zusammensetzung der meisten tierischen Proteine entspricht in etwa der durchschnittlichen Zusammensetzung der Proteine im menschlichen Körper, sodass es unwahrscheinlich ist, dass wir einem Aminosäuremangel ausgesetzt sind, wenn unsere Ernährung reich an Lebensmitteln wie Fleisch, Eiern, Milch und Käse ist. Es gibt jedoch Proteine wie Gelatine (ein Produkt der Kollagendenaturierung), die nur sehr wenige essentielle Aminosäuren enthalten. Obwohl sie in diesem Sinne besser als Gelatine sind, sind pflanzliche Proteine auch arm an essentiellen Aminosäuren; besonders wenig in ihnen Lysin und Tryptophan. Eine rein vegetarische Ernährung ist jedoch keineswegs ungesund, es sei denn, sie nimmt eine etwas größere Menge an pflanzlichen Proteinen zu sich, die ausreicht, um den Körper mit essentiellen Aminosäuren zu versorgen. Das meiste Protein findet sich in Pflanzen in den Samen, insbesondere in den Samen von Weizen und verschiedenen Hülsenfrüchten. Auch junge Triebe wie Spargel sind reich an Eiweiß.
Synthetische Proteine in der Ernährung.
Durch die Zugabe kleiner Mengen synthetischer essentieller Aminosäuren oder an ihnen reicher Proteine zu unvollständigen Proteinen, wie Maisproteinen, ist es möglich, deren Nährwert deutlich zu erhöhen, d.h. wodurch die Menge an verbrauchtem Protein erhöht wird. Eine andere Möglichkeit besteht darin, Bakterien oder Hefen auf Erdölkohlenwasserstoffen unter Zugabe von Nitraten oder Ammoniak als Stickstoffquelle zu züchten. Das so gewonnene mikrobielle Protein kann als Futtermittel für Geflügel oder Vieh dienen oder direkt vom Menschen verzehrt werden. Die dritte, weit verbreitete Methode nutzt die Physiologie von Wiederkäuern. Bei Wiederkäuern im Anfangsabschnitt des Magens, dem sog. Im Pansen gibt es spezielle Formen von Bakterien und Protozoen, die fehlerhafte Pflanzenproteine in vollständigere mikrobielle Proteine umwandeln, die wiederum nach Verdauung und Aufnahme in tierische Proteine umgewandelt werden. Harnstoff, eine billige synthetische stickstoffhaltige Verbindung, kann Viehfutter zugesetzt werden. Im Pansen lebende Mikroorganismen verwenden Harnstoffstickstoff, um Kohlenhydrate (von denen im Futter viel mehr vorhanden ist) in Protein umzuwandeln. Etwa ein Drittel des gesamten Stickstoffs im Viehfutter kann in Form von Harnstoff vorliegen, was im Wesentlichen gewissermaßen chemische Proteinsynthese bedeutet.
Damit ist eines der wichtigsten Themen im Bodybuilding-Umfeld an der Reihe – Proteine. Das grundsätzliche Thema ist, weil Proteine der Hauptbaustoff für Muskeln sind, ist es ihr (Eiweiß) zu verdanken, dass die Ergebnisse des ständigen Trainings sichtbar (oder alternativ nicht sichtbar) sind. Das Thema ist nicht ganz einfach, aber wenn man es gründlich versteht, dann kommt man um die Entlastungsmuskulatur einfach nicht mehr herum.
Nicht alle, die sich als Bodybuilder bezeichnen oder einfach nur ins Fitnessstudio gehen, kennen sich mit dem Thema Proteine gut aus. Normalerweise endet Wissen irgendwo an der Grenze zu „Proteine sind gut und sie müssen gegessen werden“. Heute müssen wir in solchen Fragen tief und gründlich verstehen wie:
Die Struktur und Funktion von Proteinen;
Mechanismen der Proteinsynthese;
Wie bauen Proteine Muskeln auf und so weiter.
Im Allgemeinen werden wir bei der Ernährung von Bodybuildern jede Kleinigkeit berücksichtigen und ihnen große Aufmerksamkeit schenken.
Proteine: Beginnend mit der Theorie
Wie in früheren Materialien wiederholt erwähnt wurde, gelangen Lebensmittel in Form von Nährstoffen in den menschlichen Körper: Proteine, Fette, Kohlenhydrate, Vitamine, Mineralien. Aber Informationen darüber, wie viel Sie bestimmte Substanzen konsumieren müssen, um bestimmte Ziele zu erreichen, wurden nie erwähnt. Heute werden wir darüber sprechen.
Wenn wir über die Definition von Protein sprechen, dann ist die einfachste und verständlichste Aussage Engels bezüglich der Tatsache, dass die Existenz von Proteinkörpern Leben ist. Sofort wird klar, kein Protein – kein Leben. Wenn wir diese Definition auf der Ebene des Bodybuildings betrachten, dann gibt es ohne Protein keine Entlastungsmuskeln. Jetzt ist es an der Zeit, ein wenig in die Wissenschaft einzutauchen.
Protein (Protein) ist eine hochmolekulare organische Substanz, die aus Alphasäuren besteht. Diese winzigen Partikel sind durch Peptidbindungen zu einer einzigen Kette verbunden. Die Zusammensetzung des Proteins umfasst 20 Arten von Aminosäuren (9 davon sind essentiell, dh sie werden im Körper nicht synthetisiert, und die restlichen 11 sind nicht essentiell).
Unverzichtbar sind:
- Leucin;
- Valin;
- Isoleucin;
- Litsin;
- Tryptophan;
- Histidin;
- Threonin;
- Methionin;
- Phenylalanin.
Zu den Ersatzprodukten gehören:
- Alanin;
- Serin;
- Cystin;
- Arginin;
- Tyrosin;
- Prolin;
- Glycin;
- Asparagin;
- Glutamin;
- Asparagin- und Glutaminsäure.
Neben diesen konstituierenden Aminosäuren gibt es auch andere, die nicht in der Zusammensetzung enthalten sind, aber eine wichtige Rolle spielen. Beispielsweise ist Gamma-Aminobuttersäure an der Übertragung von Nervenimpulsen des Nervensystems beteiligt. Dihydroxyphenylalanin hat die gleiche Funktion. Ohne diese Substanzen würde das Training zu einer unverständlichen Sache, und die Bewegungen würden wie unberechenbare Zuckungen einer Amöbe aussehen.
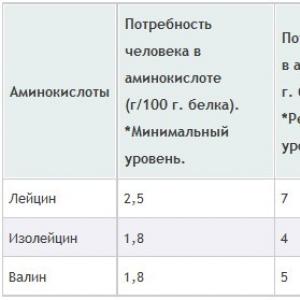
Die wichtigsten Aminosäuren für den Körper (in der Stoffwechselebene betrachtet) sind:
Isoleucin;
Diese Aminosäuren werden auch als BCAAs bezeichnet.
Jede der drei Aminosäuren spielt eine wichtige Rolle in den Prozessen, die mit den Energiekomponenten in der Arbeit der Muskeln verbunden sind. Und damit diese Prozesse so korrekt und effizient wie möglich ablaufen, sollte jede von ihnen (Aminosäuren) Teil der täglichen Ernährung sein (zusammen mit natürlichen Lebensmitteln oder als Nahrungsergänzungsmittel). Um spezifische Daten darüber zu erhalten, wie viel Sie wichtige Aminosäuren zu sich nehmen müssen, studieren Sie die Tabelle:

Alle Proteine enthalten Elemente wie:
- Kohlenstoff;
- Wasserstoff;
- Schwefel;
- Sauerstoff;
- Stickstoff;
- Phosphor.
Angesichts dessen ist es sehr wichtig, ein solches Konzept wie die Stickstoffbilanz nicht zu vergessen. Der menschliche Körper kann als eine Art Stickstoffverarbeitungsstation bezeichnet werden. Und das alles, weil Stickstoff nicht nur mit der Nahrung in den Körper gelangt, sondern auch daraus freigesetzt wird (beim Abbau von Proteinen).
Die Differenz zwischen verbrauchter und freigesetzter Stickstoffmenge ist die Stickstoffbilanz. Sie kann sowohl positiv (wenn mehr verbraucht als zugeteilt wird) als auch negativ (umgekehrt) sein. Und wenn Sie Muskelmasse aufbauen und schöne Entlastungsmuskeln aufbauen möchten, ist dies nur unter Bedingungen einer positiven Stickstoffbilanz möglich.
Wichtig:
Je nachdem, wie trainiert der Athlet ist, kann eine unterschiedliche Stickstoffmenge erforderlich sein, um das erforderliche Stickstoffgleichgewicht aufrechtzuerhalten (pro 1 kg Körpergewicht). Die durchschnittlichen Zahlen sind:
- Sportler mit Erfahrung (ca. 2-3 Jahre) - 2 g pro 1 kg Körpergewicht;
- Anfängersportler (bis 1 Jahr alt) - 2 oder 3 g pro 1 kg Körpergewicht.
Aber Protein ist nicht nur ein Strukturelement. Es ist auch in der Lage, eine Reihe anderer wichtiger Funktionen auszuführen, die nachstehend ausführlicher erörtert werden.
Über die Funktionen von Proteinen
Proteine können nicht nur die Wachstumsfunktion erfüllen (an der Bodybuilder so interessiert sind), sondern auch viele andere ebenso wichtige:

Der menschliche Körper ist ein intelligentes System, das selbst weiß, wie und was funktionieren soll. So weiß der Körper beispielsweise, dass Protein als Energiequelle für die Arbeit dienen kann (Reservekräfte), aber es ist nicht praktikabel, diese Reserven zu verbrauchen, daher ist es besser, Kohlenhydrate abzubauen. Wenn der Körper jedoch eine kleine Menge Kohlenhydrate enthält, hat der Körper keine andere Wahl, als Protein abzubauen. Daher ist es sehr wichtig, den Gehalt an Kohlenhydraten in ausreichender Menge in Ihrer Ernährung nicht zu vergessen.
Jede einzelne Proteinart hat eine andere Wirkung auf den Körper und trägt auf unterschiedliche Weise zum Wachstum der Muskelmasse bei. Dies liegt an der unterschiedlichen chemischen Zusammensetzung und Strukturmerkmalen der Moleküle. Dies führt nur dazu, dass sich der Sportler an die Quellen hochwertiger Proteine erinnern muss, die als Baumaterial für die Muskeln dienen. Die wichtigste Rolle wird dabei einem Wert wie der biologischen Wertigkeit von Proteinen (die Menge, die sich nach dem Verzehr von 100 Gramm Protein im Körper ablagert) zugeschrieben. Eine weitere wichtige Nuance ist, dass dieses Protein bei einer biologischen Wertigkeit von eins den gesamten notwendigen Satz an essentiellen Aminosäuren enthält.
Wichtig: Betrachten Sie die Bedeutung der biologischen Wertigkeit anhand eines Beispiels: Bei einem Hühner- oder Wachtelei beträgt der Koeffizient 1 und bei Weizen genau die Hälfte (0,54). Es stellt sich also heraus, dass selbst wenn die Produkte die gleiche Menge an notwendigen Proteinen pro 100 g des Produkts enthalten, mehr davon aus Eiern als aus Weizen aufgenommen werden.
Sobald eine Person Proteine im Inneren zu sich nimmt (zusammen mit Lebensmitteln oder als Nahrungsergänzungsmittel), beginnen sie im Magen-Darm-Trakt (dank Enzymen) zu einfacheren Produkten (Aminosäuren) zu zerfallen und dann zu:
- Wasser;
- Kohlendioxid;
- Ammoniak.
Danach werden die Stoffe durch die Darmwände ins Blut aufgenommen, um dann zu allen Organen und Geweben transportiert zu werden.
So unterschiedliche Proteine
Das beste Proteinfutter ist das tierischen Ursprungs, da es mehr Nährstoffe und Aminosäuren enthält, jedoch sollten pflanzliche Proteine nicht vernachlässigt werden. Idealerweise sollte das Verhältnis so aussehen:
- 70-80 % der Lebensmittel sind tierischen Ursprungs;
- 20-30 % der Lebensmittel sind pflanzlichen Ursprungs.
Betrachtet man Proteine nach dem Grad ihrer Verdaulichkeit, dann lassen sie sich in zwei große Kategorien einteilen:
Schnell. Moleküle werden sehr schnell in ihre einfachsten Bestandteile zerlegt:
- Fische;
- Hühnerbrust;
- Eier;
- Meeresfrüchte.
Langsam. Moleküle werden sehr langsam in ihre einfachsten Bestandteile zerlegt:
- Hüttenkäse.
Wenn wir das Protein durch das Prisma des Bodybuildings betrachten, dann bedeutet es ein hochkonzentriertes Protein (Eiweiß). Als häufigste Proteine gelten (je nachdem, wie sie aus Produkten gewonnen werden):
- Aus Molke - am schnellsten absorbiert, aus Molke gewonnen und hat den höchsten biologischen Wert;
- Aus Eiern - resorbiert innerhalb von 4-6 Stunden und zeichnet sich durch einen hohen biologischen Wert aus;
- Aus Soja - ein hoher biologischer Wert und eine schnelle Assimilation;
- Casein - länger verdaut als andere.
Vegetarische Sportler müssen eines beachten: Pflanzliches Protein (aus Soja und Pilzen) ist unterlegen (insbesondere in Bezug auf die Aminosäurezusammensetzung).
Vergessen Sie daher nicht, all diese wichtigen Informationen bei der Erstellung Ihrer Ernährung zu berücksichtigen. Besonders wichtig ist es, die essentiellen Aminosäuren zu berücksichtigen und beim Verzehr im Gleichgewicht zu halten. Lassen Sie uns als nächstes über die Struktur von Proteinen sprechen.
Einige Informationen über die Struktur von Proteinen
Wie Sie bereits wissen, sind Proteine komplexe makromolekulare organische Substanzen, die eine 4-stufige strukturelle Organisation haben:
- primär;
- sekundär;
- Tertiär;
- Quartär.

Es ist überhaupt nicht notwendig, dass sich ein Sportler mit den Details der Anordnung von Elementen und Bindungen in Proteinstrukturen befasst, aber jetzt müssen wir uns mit dem praktischen Teil dieses Problems befassen.
Einige Proteine werden innerhalb kurzer Zeit aufgenommen, während andere viel länger benötigen. Und es hängt vor allem von der Struktur der Proteine ab. Beispielsweise werden Proteine in Eiern und Milch sehr schnell aufgenommen, da sie in Form von einzelnen Molekülen vorliegen, die zu Kugeln gefaltet sind. Während des Essens gehen einige dieser Verbindungen verloren, und es wird für den Körper viel einfacher, die veränderte (vereinfachte) Proteinstruktur aufzunehmen.
Durch die Wärmebehandlung nimmt natürlich der Nährwert der Produkte etwas ab, aber das ist kein Grund, Rohkost zu essen (keine Eier kochen und keine Milch kochen).
Wichtig: Wenn Sie rohe Eier essen möchten, können Sie Wachteleier anstelle von Hühnereiern essen (Wachteln sind nicht anfällig für Salmonellose, da ihre Körpertemperatur mehr als 42 Grad beträgt).
Wenn wir von Fleisch sprechen, dann sind ihre Fasern ursprünglich nicht zum Verzehr bestimmt. Ihre Hauptaufgabe ist es, Kraft zu erzeugen. Aus diesem Grund sind Fleischfasern zäh, vernetzt und schwer verdaulich. Das Kochen des Fleisches vereinfacht diesen Vorgang etwas und hilft dem Magen-Darm-Trakt, die Querverbindungen in den Fasern abzubauen. Aber selbst unter solchen Bedingungen dauert die Aufnahme von Fleisch 3 bis 6 Stunden. Als Bonus für eine solche "Qual" gibt es Kreatin, das eine natürliche Quelle für gesteigerte Effizienz und Kraft ist.
Die meisten Pflanzenproteine kommen in Hülsenfrüchten und verschiedenen Samen vor. Proteinbindungen in ihnen sind ziemlich stark „versteckt“, daher braucht es viel Zeit und Mühe, um sie für den Körper zum Arbeiten zu bringen. Pilzprotein ist genauso schwer verdaulich. Die goldene Mitte in der Welt der pflanzlichen Proteine ist Soja, das leicht verdaulich ist und über eine ausreichende biologische Wertigkeit verfügt. Aber das bedeutet nicht, dass ein Soja ausreicht, sein Protein ist defekt, also muss es mit tierischen Proteinen kombiniert werden.
Und jetzt ist es an der Zeit, sich die Produkte mit dem höchsten Proteingehalt genauer anzusehen, denn sie helfen beim Aufbau von Entlastungsmuskeln:

Nachdem Sie die Tabelle sorgfältig studiert haben, können Sie sofort Ihre ideale Ernährung für den ganzen Tag erstellen. Die Hauptsache dabei ist, die Grundprinzipien der rationellen Ernährung sowie die erforderliche Menge an Protein, die tagsüber verzehrt wird, nicht zu vergessen. Um das Material zu festigen, geben wir ein Beispiel:
Es ist sehr wichtig, nicht zu vergessen, dass Sie eine Vielzahl von proteinhaltigen Lebensmitteln zu sich nehmen müssen. Sie müssen sich nicht quälen und die ganze Woche hintereinander eine Hähnchenbrust oder Hüttenkäse essen. Es ist viel effektiver, Produkte zu wechseln und dann sind Entlastungsmuskeln gleich um die Ecke.
Und noch eine Frage gilt es zu klären.
So beurteilen Sie die Qualität von Proteinen: Kriterien
Der Begriff „biologische Wertigkeit“ wurde bereits im Material erwähnt. Betrachten wir seine Werte aus chemischer Sicht, dann ist dies die Menge an Stickstoff, die im Körper zurückgehalten wird (von der insgesamt aufgenommenen Menge). Diese Messungen basieren auf der Tatsache, dass die Stickstoffretention umso höher ist, je höher der Gehalt an essentiellen essentiellen Aminosäuren ist.
Aber das ist nicht der einzige Indikator. Daneben gibt es noch andere:
Aminosäureprofil (vollständig). Alle Proteine im Körper müssen in ihrer Zusammensetzung ausgewogen sein, d. h. Proteine in Lebensmitteln mit essentiellen Aminosäuren müssen vollständig den Proteinen entsprechen, die im menschlichen Körper vorhanden sind. Nur unter solchen Bedingungen wird die Synthese der eigenen Proteinverbindungen nicht gestört und nicht auf Wachstum, sondern auf Zerfall umgelenkt.
Verfügbarkeit von Aminosäuren in Proteinen. Lebensmittel, die reich an Farb- und Konservierungsstoffen sind, haben weniger Aminosäuren zur Verfügung. Der gleiche Effekt wird durch starke Wärmebehandlung verursacht.
Die Fähigkeit zu verdauen. Dieser Indikator gibt an, wie viel Zeit für den Abbau von Proteinen in ihre einfachsten Bestandteile mit anschließender Aufnahme in das Blut benötigt wird.
Verwertung von Proteinen (rein). Dieser Indikator gibt Auskunft darüber, wie viel Stickstoff zurückgehalten wird, sowie die Gesamtmenge an verdautem Protein.
Proteineffizienz. Ein spezieller Indikator, der die Wirksamkeit des Einflusses eines Proteins auf den Muskelaufbau zeigt.
Der Grad der Proteinassimilation durch die Zusammensetzung der Aminosäuren. Hier ist es wichtig, sowohl die chemische Bedeutung und den Wert als auch den biologischen zu berücksichtigen. Wenn der Koeffizient gleich eins ist, bedeutet dies, dass das Produkt optimal ausgewogen ist und eine ausgezeichnete Proteinquelle darstellt. Und jetzt ist es an der Zeit, sich die Zahlen für jedes Produkt in der Ernährung des Sportlers genauer anzusehen (siehe Abbildung):

Und jetzt ist es an der Zeit, Bilanz zu ziehen.
Das Wichtigste, woran man sich erinnern sollte
Es wäre falsch, nicht alle oben genannten Punkte zusammenzufassen und nicht das Wichtigste hervorzuheben, an das sich diejenigen erinnern sollten, die lernen möchten, wie man mit der schwierigen Frage der Zusammenstellung der optimalen Ernährung für das Wachstum von Entlastungsmuskeln umgeht. Wenn Sie also Protein richtig in Ihre Ernährung aufnehmen möchten, vergessen Sie nicht solche Merkmale und Nuancen wie:
- Es ist wichtig, dass tierische Proteine in der Ernährung überwiegen und nicht pflanzlichen Ursprungs (im Verhältnis von 80% zu 20%);
- Am besten kombinieren Sie tierische und pflanzliche Proteine in Ihrer Ernährung;
- Denken Sie immer an die erforderliche Menge an Proteinen in Übereinstimmung mit dem Körpergewicht (2-3 g pro 1 kg Körpergewicht);
- Vergiss nicht die Qualität des Proteins, das du zu dir nimmst (d. h. achte darauf, woher du es bekommst);
- Schließen Sie Aminosäuren nicht aus, die der Körper nicht selbst produzieren kann;
- Versuchen Sie, Ihre Ernährung nicht zu erschöpfen und vermeiden Sie Verzerrungen in Bezug auf bestimmte Nährstoffe.
- Damit Proteine am besten aufgenommen werden können, nehmen Sie Vitamine und ganze Komplexe ein.
Gefallen? - Sag deinen Freunden!
Es ist bekannt, dass lebende Materie auf organischen Substanzen basiert - Proteinen, Fetten, Kohlenhydraten und Nukleinsäuren. Aber der wichtigste unter diesen Stoffen ist Protein.
Die meisten der Wissenschaft bekannten Substanzen werden beim Erhitzen von fest zu flüssig. Aber es gibt Substanzen, die im Gegenteil beim Erhitzen in einen festen Zustand übergehen. Diese Stoffe wurden 1777 von dem französischen Chemiker Pierre Joseph Macke zu einer eigenen Klasse zusammengefasst. In Analogie zum Eiweiß, das beim Erhitzen gerinnt, wurden diese Stoffe Proteine genannt. Proteine sind auch als Proteine bekannt. Eiweiß (proteios) bedeutet im Griechischen „an erster Stelle“. Das Protein erhielt diesen Namen im Jahr 1838, als der niederländische Biochemiker Gerard Mulder schrieb, dass das Leben auf dem Planeten ohne eine bestimmte Substanz unmöglich wäre, die die wichtigste aller der Wissenschaft bekannten Substanzen ist und die notwendigerweise in absolut allen Pflanzen und Tieren vorhanden ist . Mulder nannte diese Substanz Protein.
Protein ist die komplexeste Substanz unter allen Nährstoffen. In jeder Zelle des menschlichen Körpers finden chemische Reaktionen statt, bei denen Proteine eine sehr wichtige Rolle spielen.
Woraus besteht protein

Proteine umfassen: Stickstoff, Sauerstoff, Wasserstoff, Kohlenstoff. Aber andere Nährstoffe enthalten keinen Stickstoff.
Protein ist ein natürliches Polymer. Polymere sind Stoffe, deren Moleküle sehr viele Atome enthalten. Bereits im 19. Jahrhundert bewies der russische Chemiker Alexander Mikhailovich Butlerov, dass sich mit einer Änderung der Struktur des Moleküls auch die Eigenschaften der Substanz ändern. Die Hauptbausteine von Proteinen sind Aminosäuren. Proteine enthalten verschiedene Kombinationen von Aminosäuren. Daher gibt es in der Natur eine Vielzahl von Proteinen mit unterschiedlichen Eigenschaften. Mit Hilfe der Forschung wurden etwa 20 Aminosäuren entdeckt, die an der Bildung von Proteinen beteiligt sind.
Wie ist der Prozess der Bildung eines Proteinmoleküls

Aminosäuren werden sequentiell aneinander gebunden. Als Ergebnis dieses Prozesses wird eine Kette gebildet, die als Polypeptid bezeichnet wird. Anschließend können sich die Polypeptide zusammenrollen oder eine andere Form annehmen. Die Eigenschaften eines Proteins hängen von der Zusammensetzung der Aminosäuren ab, davon, wie viele Aminosäuren an der Synthese beteiligt sind und in welcher Reihenfolge diese Aminosäuren aneinander hängen. Zum Beispiel umfasst die Synthese von zwei Proteinen die gleiche Anzahl von Aminosäuren, die auch die gleiche Zusammensetzung haben. Liegen diese Aminosäuren aber in einer anderen Reihenfolge, dann erhalten wir zwei völlig unterschiedliche Proteine.
Wenn die Peptide nicht mehr als 15 Aminosäurereste enthalten, werden sie als Oligopeptide bezeichnet. Und Peptide, die bis zu mehreren Zehntausend oder sogar Hunderttausenden von Aminosäureresten enthalten, werden Proteine genannt. Das Proteinmolekül hat eine kompakte räumliche Struktur. Diese Struktur kann in Form von Fasern vorliegen. Solche Proteine werden als fibrillär bezeichnet. Sie bauen Proteine auf. Wenn das Proteinmolekül eine Struktur in Form einer Kugel hat, werden die Proteine \u200b\u200bglobular genannt. Zu diesen Proteinen gehören Enzyme, Antikörper und einige Hormone.
Abhängig davon, welche Aminosäuren in der Zusammensetzung von Proteinen enthalten sind, sind Proteine vollständig und unvollständig. Vollständige Proteine enthalten einen vollständigen Satz von Aminosäuren. Unvollständige Proteine, einige Aminosäuren fehlen.
Proteine werden auch in einfache und komplexe unterteilt. Einfache Proteine enthalten nur Aminosäuren. Die Zusammensetzung komplexer Proteine umfasst neben Aminosäuren auch Metalle, Kohlenhydrate, Lipide und Nukleinsäuren.
Die Rolle von Proteinen im menschlichen Körper

Proteine erfüllen verschiedene Funktionen im menschlichen Körper.
1.Strukturell. Proteine sind Bestandteil der Zellen aller Gewebe und Organe.
2. Schützend. Das Interferon-Protein wird im Körper zum Schutz vor Viren synthetisiert.
3. Dwigatelna ICH. Das Protein Myosin ist am Prozess der Muskelkontraktion beteiligt.
4. Transport. Hämoglobin, ein Protein in der Zusammensetzung roter Blutkörperchen, ist an der Übertragung von Sauerstoff und Kohlendioxid beteiligt.
5. Energie ICH. Durch die Oxidation von Proteinmolekülen wird die für das Leben des Körpers notwendige Energie freigesetzt.
6. katalytisch ICH. Proteinenzyme wirken als biologische Katalysatoren, die die Geschwindigkeit chemischer Reaktionen in Zellen erhöhen.
7. Regulierung ICH. Hormone regulieren verschiedene Körperfunktionen. Beispielsweise reguliert Insulin den Blutzuckerspiegel.
In der Natur gibt es eine Vielzahl von Proteinen, die verschiedenste Funktionen erfüllen können. Aber die wichtigste Funktion von Proteinen besteht darin, zusammen mit anderen Biomolekülen das Leben auf der Erde aufrechtzuerhalten.
Senden Sie Ihre gute Arbeit in die Wissensdatenbank ist einfach. Verwenden Sie das untenstehende Formular
Studenten, Doktoranden, junge Wissenschaftler, die die Wissensbasis in ihrem Studium und ihrer Arbeit nutzen, werden Ihnen sehr dankbar sein.
Veröffentlicht am http://www.allbest.ru
KAPITEL 1 EINLEITUNG
Berichte über eine Revolution in der Biologie sind mittlerweile eher banal geworden. Als unbestreitbar gilt auch, dass diese revolutionären Veränderungen mit der Herausbildung eines Komplexes von Wissenschaften an der Schnittstelle von Biologie und Chemie einhergingen, unter denen die Molekularbiologie und die Bioorganische Chemie die zentrale Stellung einnahmen und einnahmen.
„Molekularbiologie ist eine Wissenschaft, die darauf abzielt, die Natur von Lebensphänomenen zu verstehen, indem sie biologische Objekte und Systeme auf einer Ebene untersucht, die sich der molekularen annähert ... charakteristische Manifestationen des Lebens ... sind auf die Struktur, Eigenschaften und Interaktion von Molekülen zurückzuführen biologisch wichtige Substanzen, in erster Linie Proteine und Nukleinsäuren ”
„Bioorganische Chemie ist eine Wissenschaft, die die Substanzen untersucht, die Lebensprozessen zugrunde liegen ... die Hauptobjekte der bioorganischen Chemie sind Biopolymere (Proteine und Peptide, Nukleinsäuren und Nukleotide, Lipide, Polysaccharide usw.).
Aus diesem Vergleich wird deutlich, wie wichtig die Erforschung von Proteinen für die Entwicklung der modernen Biologie ist.
Biologie Proteinbiochemie
KAPITEL 2. GESCHICHTE DER PROTEINFORSCHUNG
2.1 Frühe Stadien der Proteinchemie
Protein gehörte vor 250 Jahren zu den Objekten der chemischen Forschung. 1728 gewann der italienische Wissenschaftler Jacopo Bartolomeo Beccari das erste Proteinpräparat, Gluten, aus Weizenmehl. Er unterzog Gluten einer Trockendestillation und stellte sicher, dass die Produkte dieser Destillation alkalisch waren. Dies war der erste Beweis für die Einheit der Natur der Substanzen des Pflanzen- und Tierreiches. Er veröffentlichte die Ergebnisse seiner Arbeit im Jahr 1745, und dies war die erste Arbeit über ein Protein.
Im XVIII - frühen XIX Jahrhundert wurden wiederholt Proteinsubstanzen pflanzlichen und tierischen Ursprungs beschrieben. Ein Merkmal solcher Beschreibungen war die Konvergenz dieser Substanzen und ihr Vergleich mit anorganischen Substanzen.
Es ist wichtig anzumerken, dass zu dieser Zeit, noch vor dem Aufkommen der Elementaranalyse, die Vorstellung bestand, dass Proteine aus verschiedenen Quellen eine Gruppe einzelner Substanzen mit ähnlichen Eigenschaften sind.
1810 bestimmten J. Gay-Lussac und L. Tenard erstmals die elementare Zusammensetzung von Proteinsubstanzen. 1833 bewies J. Gay-Lussac, dass Stickstoff notwendigerweise in Proteinen vorhanden ist, und es wurde bald gezeigt, dass der Stickstoffgehalt in verschiedenen Proteinen ungefähr gleich ist. Zur gleichen Zeit versuchte der englische Chemiker D. Dalton, die ersten Formeln von Proteinsubstanzen darzustellen. Er stellte sie als ziemlich einfache Substanzen dar, aber um ihre individuellen Unterschiede bei gleicher Zusammensetzung hervorzuheben, griff er auf die Darstellung von Molekülen zurück, die man heute als isomer bezeichnen würde. Das Konzept der Isomerie existierte jedoch zu Daltons Zeit noch nicht.
Proteinformeln von D. Dalton
Die ersten Summenformeln von Proteinen wurden abgeleitet und erste Hypothesen über die Gesetzmäßigkeiten ihrer Zusammensetzung aufgestellt. So glaubte N. Lieberkün, dass Albumin durch die Formel C 72 H 112 N 18 SO 22 beschrieben wird, und A. Danilevsky glaubte, dass das Molekül dieses Proteins mindestens eine Größenordnung größer ist: C 726 H 1171 N 194 S 3 O 214.
Der deutsche Chemiker J. Liebig schlug 1841 vor, dass tierische Proteine Analoga zu pflanzlichen Proteinen haben: Die Assimilation von Hülsenfruchtprotein im tierischen Körper führte laut Liebig zur Akkumulation eines ähnlichen Proteins - Casein. Eine der am weitesten verbreiteten Theorien der prästrukturellen organischen Chemie war die Theorie der Radikale, der unveränderlichen Bestandteile verwandter Substanzen. 1836 schlug der Holländer G. Mulder vor, dass alle Proteine das gleiche Radikal enthalten, das er nannte Protein (vom griechischen Wort „Ich übernehme die Führung“, „Ich nehme den ersten Platz ein“). Das Protein hatte laut Mulder die Zusammensetzung Pr = C 40 H 62 N 10 O 12 . 1838 veröffentlichte G. Mulder Proteinformeln basierend auf der Proteintheorie. Das waren die sog. dualistische Formeln, bei denen das Proteinradikal als positive Gruppierung diente und Schwefel- oder Phosphoratome als negative. Zusammen bildeten sie ein elektrisch neutrales Molekül: Blutserumprotein Pr 10 S 2 P, Fibrin Pr 10 SP. Eine analytische Überprüfung der Daten von G. Mulder, durchgeführt von dem russischen Chemiker Lyaskovskii sowie Yu. Liebig, zeigte jedoch, dass "Eiweißradikale" nicht existieren.
1833 entdeckte der deutsche Wissenschaftler F. Rose die Biuret-Reaktion für Proteine – eine der gegenwärtig wichtigsten Farbreaktionen für Proteinsubstanzen und ihre Derivate (mehr zu Farbreaktionen auf Seite 53). Es wurde auch der Schluss gezogen, dass dies die empfindlichste Reaktion für ein Protein war, weshalb sie damals die größte Aufmerksamkeit der Chemiker auf sich zog.
Mitte des 19. Jahrhunderts wurden zahlreiche Verfahren entwickelt, um Proteine zu extrahieren, zu reinigen und in Lösungen neutraler Salze zu isolieren. 1847 entdeckte K. Reichert die Fähigkeit von Proteinen, Kristalle zu bilden. 1836 entdeckte T. Schwann Pepsin, ein Enzym, das Proteine abbaut. 1856 entdeckte L. Corvisar ein weiteres ähnliches Enzym - Trypsin. Durch die Untersuchung der Wirkung dieser Enzyme auf Proteine versuchten Biochemiker, das Geheimnis der Verdauung zu lüften. Die meiste Aufmerksamkeit wurde jedoch Substanzen geschenkt, die aus der Wirkung von protelytischen Enzymen (Proteasen, dazu gehören die oben genannten Enzyme) auf Proteine entstehen: Einige von ihnen waren Fragmente der ursprünglichen Proteinmoleküle (sie wurden als Peptone ), während andere keiner weiteren Spaltung durch Proteasen unterzogen wurden und zu der seit Anfang des Jahrhunderts bekannten Verbindungsklasse der Aminosäuren gehörten (das erste Aminosäurederivat, Asparaginamid, wurde 1806 entdeckt, und die erste Aminosäure, Cystin, 1810). Aminosäuren in der Zusammensetzung von Proteinen wurden erstmals 1820 von dem französischen Chemiker A. Braconno entdeckt. Er wendete die saure Hydrolyse des Proteins an und fand im Hydrolysat eine süßliche Substanz, die er Glycin nannte. 1839 wurde die Existenz von Leucin in Proteinen nachgewiesen, und 1849 isolierte F. Bopp eine weitere Aminosäure aus Protein – Tyrosin (siehe Anhang II für eine vollständige Liste der Entdeckungsdaten von Aminosäuren in Proteinen).
Bis Ende der 80er. Bereits im 19. Jahrhundert wurden 19 Aminosäuren aus Proteinhydrolysaten isoliert, und langsam setzte sich die Meinung durch, dass Informationen über die Produkte der Proteinhydrolyse wichtige Informationen über die Struktur des Proteinmoleküls enthalten. Aminosäuren galten jedoch als essentiell, aber nicht als Hauptbestandteil des Proteins.
Im Zusammenhang mit den Entdeckungen von Aminosäuren in der Zusammensetzung von Proteinen hat der französische Wissenschaftler P. Schutzenberger in den 70er Jahren. XIX Jahrhundert schlug die sogenannte vor. Ureid-Theorie Proteinstrukturen. Demnach bestand ein Proteinmolekül aus einem zentralen Kern, dessen Rolle ein Tyrosinmolekül spielte, und daran gebundenen komplexen Gruppen (unter Substitution von 4 Wasserstoffatomen), Schutzenberger genannt Leucine . Die Hypothese wurde jedoch experimentell nur sehr schwach gestützt, und weitere Forschungen erwiesen sich als widersprüchlich.
2.2 Theorie der „Kohlenstoff-Stickstoff-Komplexe“ A.Ya. Danilevsky
Die ursprüngliche Theorie über die Struktur des Proteins wurde in den 80er Jahren zum Ausdruck gebracht. Der russische Biochemiker A. Ja. Danilevsky aus dem 19. Jahrhundert. Er war der erste Chemiker, der auf die mögliche polymere Natur der Struktur von Proteinmolekülen aufmerksam machte. In den frühen 70er Jahren. Er schrieb an A.M. Butlerov, dass „Albuminpartikel ein gemischtes Polymer sind“, dass er für die Definition von Protein „keinen Begriff findet, der geeigneter ist als das Wort Polymer im weitesten Sinne“. Er untersuchte die Biuret-Reaktion und schlug vor, dass diese Reaktion mit der Struktur von intermittierenden Kohlenstoff- und Stickstoffatomen - N - C - N - C - N - verbunden ist, die in den sogenannten enthalten sind. Carbonazo t Komplex R "- NH - CO - NH - CO - R". Basierend auf dieser Formel glaubte Danilevsky, dass das Proteinmolekül 40 solcher Kohlenstoff-Stickstoff-Komplexe enthält. Separate Kohlenstoff-Stickstoff-Aminosäure-Komplexe sahen laut Danilevsky so aus:
Kohlenstoff-Stickstoff-Komplexe könnten laut Danilevsky durch eine Ether- oder Amidbindung zu einer hochmolekularen Struktur verbunden werden.
2.3 Die Theorie der „Kirins“ A. Kössel
Der deutsche Physiologe und Biochemiker A. Kossel hat bei der Untersuchung von Protaminen und Histonen, relativ einfachen Proteinen, festgestellt, dass während ihrer Hydrolyse eine große Menge Arginin gebildet wird. Außerdem entdeckte er in der Zusammensetzung des Hydrolysats die damals unbekannte Aminosäure Histidin. Darauf aufbauend schlug Kossel vor, dass diese Proteinsubstanzen als einige einfache Modelle komplexerer Proteine betrachtet werden können, die seiner Meinung nach nach folgendem Prinzip aufgebaut sind: Arginin und Histidin bilden einen zentralen Kern („Protaminkern“), der ist umgeben von Komplexen anderer Aminosäuren.
Kossels Theorie war das perfekteste Beispiel für die Entwicklung der Hypothese der fragmentierten Struktur von Proteinen (zuerst vorgeschlagen, wie oben erwähnt, von G. Mulder). Diese Hypothese wurde Anfang des 20. Jahrhunderts vom deutschen Chemiker M. Siegfried verwendet. Er glaubte, dass Proteine aus Komplexen von Aminosäuren (Arginin + Lysin + Glutaminsäure) aufgebaut sind, die er nannte Kirinami (vom griechischen „kyrios“ basic). Diese Hypothese wurde jedoch 1903 aufgestellt, als E. Fisher seine aktiv entwickelte Peptidtheorie , die den Schlüssel zum Geheimnis der Struktur von Proteinen lieferte.
2.4 Peptidtheorie E. Fischer
Der deutsche Chemiker Emil Fischer, bereits weltberühmt für seine Studien über Purinverbindungen (Alkaloide der Koffeingruppe) und die Entschlüsselung der Struktur von Zuckern, schuf die Peptidtheorie, die zu Lebzeiten in der Praxis weitgehend bestätigt und allgemeine Anerkennung fand, für die er mit dem zweiten Nobelpreis in der Geschichte der Chemie ausgezeichnet wurde (der erste ging an Ya.G. Van't Hoff).
Es ist wichtig, dass Fisher einen Forschungsplan erstellt, der sich stark von dem unterscheidet, was zuvor gemacht wurde, aber alle damals bekannten Fakten berücksichtigt. Zunächst akzeptierte er als wahrscheinlichste Hypothese, dass Proteine aus Aminosäuren aufgebaut sind, die durch eine Amidbindung verbunden sind:
Fisher nannte diese Art von Bindung (in Analogie zu Peptonen) Peptid . Er schlug vor, dass Proteine sind Polymere von Aminosäuren, die durch Peptidbindungen verbunden sind . Die Idee der polymeren Natur der Struktur von Proteinen wurde bekanntlich von Danilevsky und Hert zum Ausdruck gebracht, aber sie glaubten, dass „Monomere“ sehr komplexe Formationen sind - Peptone oder „Kohlenstoff-Stickstoff-Komplexe“.
Nachweis des Peptidtyps der Verbindung von Aminosäureresten. E. Fisher ging von folgenden Beobachtungen aus. Zunächst wurden sowohl bei der Hydrolyse von Proteinen als auch bei ihrem enzymatischen Abbau verschiedene Aminosäuren gebildet. Andere Verbindungen waren äußerst schwierig zu beschreiben und noch schwieriger zu beschaffen. Außerdem wusste Fischer, dass bei Proteinen weder saure noch basische Eigenschaften vorherrschen, was bedeutet, dass Amino- und Carboxylgruppen in der Zusammensetzung von Aminosäuren in Proteinmolekülen geschlossen sind und sich sozusagen gegenseitig maskieren ( die Amphoterität von Proteinen, wie man jetzt sagen würde ).
Fisher unterteilte die Lösung des Problems der Proteinstruktur und reduzierte sie auf die folgenden Bestimmungen:
Qualitative und quantitative Bestimmung der Produkte der vollständigen Hydrolyse von Proteinen.
Aufbau der Struktur dieser Endprodukte.
Synthese von Aminosäurepolymeren mit Verbindungen vom Amid-(Peptid-)Typ.
Vergleich der so erhaltenen Verbindungen mit natürlichen Proteinen.
Aus diesem Plan ist ersichtlich, dass Fisher zum ersten Mal einen neuen methodischen Ansatz verwendet hat – die Synthese von Modellverbindungen, als eine Möglichkeit des Analogienachweises.
2.5 Entwicklung von Methoden zur Synthese von Aminosäuren
Um mit der Synthese von Derivaten von Aminosäuren fortzufahren, die durch eine Peptidbindung verbunden sind, hat Fischer viel Arbeit zur Untersuchung der Struktur und Synthese von Aminosäuren geleistet.
Vor Fischer war die allgemeine Methode zur Synthese von Aminosäuren die Cyanhydrinsynthese von A. Strecker:
Nach der Strecker-Reaktion war es möglich, Alanin, Serin und einige andere Aminosäuren zu synthetisieren, und nach ihrer Modifikation (Zelinsky-Stadnikov-Reaktion) sowohl -Aminosäuren als auch ihre N-substituierten.
Fischer selbst versuchte jedoch, Methoden zur Synthese aller damals bekannten Aminosäuren zu entwickeln. Er hielt Streckers Methode für nicht universell genug. Daher musste E. Fischer nach einer allgemeinen Methode zur Synthese von Aminosäuren, einschließlich Aminosäuren mit komplexen Seitenresten, suchen.
Er schlug vor, bromsubstituierte in-Position-Carbonsäuren zu aminieren. Zur Gewinnung von Bromderivaten verwendete er beispielsweise bei der Synthese von Leucin arylierte oder alkylierte Malonsäure:
Aber E. Fisher ist es nicht gelungen, eine absolut universelle Methode zu entwickeln. Es wurden auch zuverlässigere Reaktionen entwickelt. Beispielsweise schlug Fishers Schüler G. Lakes die folgende Modifikation vor, um Serin zu erhalten:
Fisher bewies auch, dass Proteine aus optisch aktiven Aminosäureresten bestehen (siehe S. 11). Dies zwang ihn, eine neue Nomenklatur optisch aktiver Verbindungen zu entwickeln, Methoden zur Trennung und Synthese optischer Isomere von Aminosäuren. Fisher kam auch zu dem Schluss, dass Proteine Reste der L-Form optisch aktiver Aminosäuren enthalten, und er bewies dies, indem er zunächst das Prinzip der Diastereoisomerie anwandte. Dieses Prinzip war wie folgt: An das N-Acyl-Derivat einer racemischen Aminosäure wurde ein optisch aktives Alkaloid (Brucin, Strychnin, Cinchonin, Chinidin, Chinin) addiert. Als Ergebnis wurden zwei stereoisomere Salzformen mit unterschiedlicher Löslichkeit gebildet. Nach Trennung dieser Diastereoisomere wurde das Alkaloid gewonnen und die Acylgruppe durch Hydrolyse entfernt.
Fischer konnte eine Methode zur vollständigen Bestimmung von Aminosäuren in Proteinhydrolyseprodukten entwickeln: Er überführte die Hydrochloridester der Aminosäuren durch Behandlung mit konzentriertem Alkali in der Kälte in freie Ester, die nicht nennenswert verseift waren. Anschließend wurde das Gemisch dieser Ether fraktioniert destilliert und aus den erhaltenen Fraktionen einzelne Aminosäuren durch fraktionierte Kristallisation isoliert.
Die neue Analysemethode bestätigte nicht nur endgültig, dass Proteine aus Aminosäureresten bestehen, sondern ermöglichte es, die Liste der in Proteinen vorkommenden Aminosäuren zu verfeinern und zu ergänzen. Dennoch konnten quantitative Analysen die Hauptfrage nicht beantworten: Was sind die Prinzipien der Struktur eines Proteinmoleküls? Und E. Fisher formulierte eine der Hauptaufgaben beim Studium der Struktur und Eigenschaften von Proteinen: die Entwicklung experimentell meMethoden zur Synthese von Verbindungen, deren Hauptbestandteile Aminosäuren wärenumSie sind durch eine Peptidbindung verbunden.
Daher stellte Fisher eine nicht triviale Aufgabe – die Synthese einer neuen Klasse von Verbindungen, um die Prinzipien ihrer Struktur zu etablieren.
Fisher löste dieses Problem, und Chemiker erhielten überzeugende Beweise dafür, dass Proteine Polymere von Aminosäuren sind, die durch eine Peptidbindung verbunden sind:
CO - CHR" - NH - CO - CHR"" - NH - CO CHR""" - NH -
Diese Position wurde durch biochemische Beweise gestützt. Dabei stellte sich heraus, dass Proteasen nicht alle Bindungen zwischen Aminosäuren gleich schnell spalten. Ihre Fähigkeit, die Peptidbindung zu spalten, wurde durch die optische Konfiguration der Aminosäuren, die Substituenten am Stickstoff der Aminogruppe, die Länge der Peptidkette und den darin enthaltenen Satz von Resten beeinflusst.
Der Hauptbeweis der Peptidtheorie war die Synthese von Modellpeptiden und deren Vergleich mit den Peptonen des Proteinhydrolysats. Die Ergebnisse zeigten, dass Peptide, die mit den synthetisierten identisch sind, aus Proteinhydrolysaten isoliert werden.
Im Zuge dieser Studien entwickelten E.Fischer und sein Schüler E.Abdergalden erstmals eine Methode zur Bestimmung der Aminosäuresequenz in einem Protein. Sein Wesen bestand darin, die Natur des Aminosäurerests des Polypeptids mit einer freien Aminogruppe (N-terminale Aminosäure) festzustellen. Dazu schlugen sie vor, den Aminoterminus im Peptid mit einer Naphthalin-Sulfonyl-Gruppe zu blockieren, die bei der Hydrolyse nicht abgespalten wird. Durch Isolierung der mit einer solchen Gruppe markierten Aminosäure aus dem Hydrolysat konnte bestimmt werden, welche der Aminosäuren N-terminal war.
Nach der Forschung von E. Fisher wurde klar, dass Proteine Polypeptide sind. Dies war eine wichtige Errungenschaft, auch für Proteinsyntheseaufgaben: es wurde klar, was genau synthetisiert werden musste. Erst nach diesen Arbeiten erhielt das Problem der Proteinsynthese eine gewisse Richtung und die notwendige Strenge.
Wenn wir über Fishers Arbeit als Ganzes sprechen, sollte angemerkt werden, dass der Forschungsansatz selbst eher typisch für das kommende 20. Jahrhundert war – er arbeitete mit einer breiten Palette theoretischer Positionen und methodologischer Techniken; Seine Synthesen sahen immer weniger wie eine Kunst aus, die auf Intuition als auf exaktem Wissen beruhte, und näherten sich der Schaffung einer Reihe präziser, fast technologischer Geräte.
2. 6 Krise der Peptidtheorie
Im Zusammenhang mit dem Einsatz neuer physikalischer und physikalisch-chemischer Forschungsmethoden Anfang der 20er Jahre. 20. Jahrhundert Es gab Zweifel, dass das Proteinmolekül eine lange Polypeptidkette ist. Die Hypothese über die Möglichkeit einer kompakten Packung von Peptidketten wurde mit Skepsis betrachtet. All dies erforderte eine Überarbeitung der Peptidtheorie von E. Fisher.
In den 20-30er Jahren. Die Diketopiperazin-Theorie ist weit verbreitet. Demnach spielen Diketopiperase-Ringe, die bei der Cyclisierung zweier Aminosäurereste entstehen, eine zentrale Rolle beim Aufbau der Proteinstruktur. Es wurde auch angenommen, dass diese Strukturen den zentralen Kern des Moleküls darstellen, an den kurze Peptide oder Aminosäuren angehängt sind („Füllstoffe“ des zyklischen Gerüsts der Hauptstruktur). Die überzeugendsten Schemata für die Beteiligung von Diketopiperazinen am Aufbau der Proteinstruktur wurden von den Studenten von N. D. Zelinsky und E. Fisher präsentiert.
Versuche, Modellverbindungen mit Diketopiperazinen zu synthetisieren, trugen jedoch wenig zur Proteinchemie bei; in der Folge triumphierte die Peptidtheorie, aber diese Arbeiten wirkten sich anregend auf die Chemie der Piperazine im Allgemeinen aus.
Nach den Peptid- und Diketopiperase-Theorien wurde weiterhin versucht, die Existenz nur von Peptidstrukturen im Proteinmolekül zu beweisen. Gleichzeitig versuchten sie, sich nicht nur die Art des Moleküls vorzustellen, sondern auch seine allgemeinen Umrisse.
Die ursprüngliche Hypothese wurde vom sowjetischen Chemiker D. L. Talmud formuliert. Er schlug vor, dass die Peptidketten in der Zusammensetzung von Proteinmolekülen zu großen Ringen gefaltet werden, was wiederum ein Schritt in Richtung seiner Idee eines Proteinkügelchens war.
Gleichzeitig tauchten Daten auf, die auf einen unterschiedlichen Satz von Aminosäuren in verschiedenen Proteinen hinwiesen. Aber die Muster, die die Reihenfolge der Aminosäuren in der Proteinstruktur bestimmen, waren nicht klar.
M. Bergman und K. Niemann haben als erste versucht, diese Frage in ihrer Hypothese der „intermittierenden Frequenzen“ zu beantworten. Danach gehorchte die Abfolge von Aminosäureresten in einem Proteinmolekül numerischen Mustern, deren Grundlagen von den Prinzipien der Struktur des Seidenfibroinproteinmoleküls abgeleitet wurden. Aber diese Wahl war erfolglos, weil. Dieses Protein ist fibrillär, während die Struktur kugelförmiger Proteine völlig anderen Mustern folgt.
Laut M. Bergman und K. Nieman kommt jede Aminosäure in der Polypeptidkette in einem bestimmten Intervall vor oder hat, wie M. Bergman sagte, eine bestimmte „Periodizität“. Diese Periodizität wird durch die Natur der Aminosäurereste bestimmt.
Sie stellten sich das Seidenfibroin-Molekül wie folgt vor:
GlyAlaGlyTyr GlyAlaGlyArg GlyAlaGlyx GlyAlaGlyx
(GlyAlaGlyTyr GlyAlaGlyx GlyAlaGlyx GlyAlaGlyx) 12
GlyAlaGlyTyr GlyAlaGlyx GlyAlaGlyx GlyAlaGlyArg
(GlyAlaGlyTyr GlyAlaGlyx GlyAlaGlyx GlyAlaGlyx) 13
Die Bergman-Niemann-Hypothese hatte einen bedeutenden Einfluss auf die Entwicklung der Aminosäurechemie, eine große Anzahl von Arbeiten wurde ihrer Überprüfung gewidmet.
Zum Abschluss dieses Kapitels sollte angemerkt werden, dass bis zur Mitte des 20. Jahrhunderts. Es wurden genügend Beweise für die Gültigkeit der Peptidtheorie gesammelt, ihre Hauptbestimmungen wurden ergänzt und verfeinert. Daher das Zentrum für Proteinforschung im 20. Jahrhundert. legen bereits das Forschungsfeld fest und suchen nach Methoden der Proteinsynthese auf künstlichem Wege. Dieses Problem wurde erfolgreich gelöst, es wurden zuverlässige Methoden zur Bestimmung der Primärstruktur eines Proteins entwickelt - die Sequenz der Aminosäuren in der Peptidkette, Methoden zur chemischen (abiogenen) Synthese unregelmäßiger Polypeptide wurden entwickelt (diese Methoden werden ausführlicher besprochen in Kapitel 8, S. 36), einschließlich Verfahren zur automatischen Synthese von Polypeptiden. Dadurch gelang es dem größten englischen Chemiker F. Senger bereits 1962, die Struktur zu entschlüsseln und das Hormon Insulin künstlich zu synthetisieren, was eine neue Ära in der Synthese funktioneller Proteinpolypeptide einläutete.
KAPITEL 3. CHEMISCHE ZUSAMMENSETZUNG VON PROTEINEN
3.1 Peptidbindung
Proteine sind unregelmäßige Polymere, die aus α-Aminosäureresten aufgebaut sind, deren allgemeine Formel in einer wässrigen Lösung bei nahezu neutralen pH-Werten als NH 3 + CHRCOO – geschrieben werden kann. Aminosäurereste in Proteinen sind durch eine Amidbindung zwischen α-Amino- und β-Carboxylgruppen miteinander verbunden. Peptidbindung zwischen zwei-Aminosäurereste werden allgemein als bezeichnet Peptidbindung , und Polymere, die aus α-Aminosäureresten aufgebaut sind, die durch Peptidbindungen verbunden sind, genannt Polypeptide. Ein Protein als biologisch bedeutsame Struktur kann entweder ein einzelnes Polypeptid oder mehrere Polypeptide sein, die durch nicht-kovalente Wechselwirkungen einen einzigen Komplex bilden.
3.2 Elementare Zusammensetzung von Proteinen
Um die chemische Zusammensetzung von Proteinen zu untersuchen, muss man erstens herausfinden, aus welchen chemischen Elementen sie bestehen, und zweitens die Struktur ihrer Monomere. Zur Beantwortung der ersten Frage wird die quantitative und qualitative Zusammensetzung der chemischen Elemente des Proteins bestimmt. Chemische Analyse zeigte in allen Proteinen vorhanden Kohlenstoff (50–55 %), Sauerstoff (21–23 %), Stickstoff (15–17 %), Wasserstoff (6–7 %), Schwefel (0,3–2,5 %). Auch Phosphor, Jod, Eisen, Kupfer und einige andere Makro- und Spurenelemente wurden in unterschiedlichen, oft sehr geringen Mengen in der Zusammensetzung einzelner Proteine gefunden.
Der Gehalt der wichtigsten chemischen Elemente in Proteinen kann variieren, mit Ausnahme von Stickstoff, dessen Konzentration durch die größte Konstanz gekennzeichnet ist und durchschnittlich 16% beträgt. Außerdem ist der Stickstoffgehalt in anderen organischen Stoffen gering. In Übereinstimmung damit wurde vorgeschlagen, die Proteinmenge durch ihren Bestandteil Stickstoff zu bestimmen. Da in 6,25 g Protein 1 g Stickstoff enthalten ist, wird die gefundene Stickstoffmenge mit dem Faktor 6,25 multipliziert und man erhält die Proteinmenge.
Um die chemische Natur von Proteinmonomeren zu bestimmen, müssen zwei Probleme gelöst werden: das Protein in Monomere zu trennen und ihre chemische Zusammensetzung herauszufinden. Der Abbau eines Proteins in seine Bestandteile erfolgt durch Hydrolyse – längeres Kochen des Proteins mit starken Mineralsäuren. (Säurehydrolyse) oder Gründe (alkalische Hydrolyse). Am gebräuchlichsten ist das Kochen bei 110 C mit HCl für 24 Stunden.Im nächsten Schritt werden die Substanzen, aus denen das Hydrolysat besteht, getrennt. Zu diesem Zweck werden verschiedene Methoden verwendet, meistens - Chromatographie (weitere Einzelheiten finden Sie im Kapitel „Forschungsmethoden ...“). Aminosäuren sind der Hauptteil der abgetrennten Hydrolysate.
3.3. Aminosäuren
Derzeit wurden bis zu 200 verschiedene Aminosäuren in verschiedenen Objekten der Tierwelt gefunden. Im menschlichen Körper gibt es zum Beispiel etwa 60. Proteine enthalten jedoch nur 20 Aminosäuren, die manchmal als natürliche Aminosäuren bezeichnet werden.
Aminosäuren sind organische Säuren, bei denen das Wasserstoffatom - Kohlenstoffatom durch eine Aminogruppe - NH 2 - ersetzt ist. Chemisch gesehen handelt es sich also um Aminosäuren mit der allgemeinen Formel:
Aus dieser Formel ist ersichtlich, dass die Zusammensetzung aller Aminosäuren die folgenden allgemeinen Gruppen umfasst: - CH 2 - NH 2 - COOH. Seitenketten (Radikale - R) Aminosäuren unterscheiden. Wie aus Anhang I ersichtlich ist, ist die chemische Natur von Radikalen vielfältig: von einem Wasserstoffatom bis hin zu zyklischen Verbindungen. Es sind die Radikale, die die strukturellen und funktionellen Eigenschaften von Aminosäuren bestimmen.
Alle Aminosäuren, mit Ausnahme der einfachsten Aminosäure Glycin (NH 3 + CH 2 COO) haben ein chirales Atom C und können in Form von zwei Enantiomeren (optischen Isomeren) vorliegen:
Alle derzeit untersuchten Proteine enthalten nur Aminosäuren der L-Reihe, bei denen, wenn wir das chirale Atom von der Seite des H-Atoms betrachten, die NH 3 + -, COO-Gruppen und der Rest R im Uhrzeigersinn angeordnet sind. Die Notwendigkeit, aus einem streng definierten Enantiomer ein biologisch bedeutsames Polymermolekül aufzubauen, liegt auf der Hand – aus einer racemischen Mischung zweier Enantiomere würde man eine unvorstellbar komplexe Mischung von Diastereoisomeren erhalten. Die Frage, warum das Leben auf der Erde auf Proteinen basiert, die genau aus L- und nicht aus D-Aminosäuren aufgebaut sind, bleibt immer noch ein faszinierendes Rätsel. Es sei darauf hingewiesen, dass D-Aminosäuren in der Natur ziemlich weit verbreitet sind und darüber hinaus Teil biologisch bedeutsamer Oligopeptide sind.
Proteine werden aus den zwanzig grundlegenden α-Aminosäuren aufgebaut, aber die restlichen, ziemlich unterschiedlichen Aminosäuren werden aus diesen 20 Aminosäureresten bereits in der Zusammensetzung des Proteinmoleküls gebildet. Unter diesen Umwandlungen ist vor allem die Entstehung zu beachten Disulfidbrücken während der Oxidation zweier Cysteinreste in der Zusammensetzung bereits gebildeter Peptidketten. Dadurch entsteht aus zwei Cysteinresten ein Diaminodicarbonsäurerest Cystin (Siehe Anhang I). In diesem Fall erfolgt die Vernetzung entweder innerhalb einer Polypeptidkette oder zwischen zwei verschiedenen Ketten. Als kleines Protein, das zwei durch Disulfidbrücken verbundene Polypeptidketten sowie Quervernetzungen innerhalb einer der Polypeptidketten aufweist:
Ein wichtiges Beispiel für die Modifikation von Aminosäureresten ist die Umwandlung von Prolinresten in Reste Hydroxyprolin :
Diese Umwandlung erfolgt in erheblichem Umfang während der Bildung eines wichtigen Proteinbestandteils des Bindegewebes - Kollagen .
Eine weitere sehr wichtige Art der Proteinmodifikation ist die Phosphorylierung von Hydroxogruppen von Serin-, Threonin- und Tyrosinresten, zum Beispiel:
Aminosäuren in wässriger Lösung befinden sich aufgrund der Dissoziation von Amino- und Carboxylgruppen, aus denen die Radikale bestehen, in einem ionisierten Zustand. Mit anderen Worten, sie sind amphotere Verbindungen und können entweder als Säuren (Protonendonoren) oder als Basen (Donorakzeptoren) existieren.
Alle Aminosäuren werden je nach Struktur in mehrere Gruppen eingeteilt:
Azyklisch. Monoaminomonocarbonsäuren haben in ihrer Zusammensetzung eine Amin- und eine Carboxylgruppe, in wässriger Lösung sind sie neutral. Einige von ihnen haben gemeinsame strukturelle Merkmale, die es ermöglichen, sie zusammen zu betrachten:
Glycin und Alanin. Glycin (Glykokol oder Aminoessigsäure) ist optisch inaktiv – es ist die einzige Aminosäure, die keine Enantiomere hat. Glycin ist an der Bildung von Nukleinsäuren und Gallenflüssigkeit beteiligt - t, Häm, ist für die Neutralisierung toxischer Produkte in der Leber notwendig. Alanin wird vom Körper in verschiedenen Prozessen des Kohlenhydrat- und Energiestoffwechsels verwendet. Sein Isomer - Alanin ist ein wesentlicher Bestandteil des Pantothensäure-Vitamins - Sie, Coenzym A (CoA), Extraktstoffe der Muskeln.
Serin und Threonin. Sie gehören zur Gruppe der Hydrohydroxysäuren, weil. eine Hydroxylgruppe haben. Serin ist Bestandteil verschiedener Enzyme, des Haupteiweißes der Milch - Kasein, sowie Bestandteil vieler Lipoproteine. Threonin ist als essentielle Aminosäure an der Proteinbiosynthese beteiligt.
Cystein und Methionin. Aminosäuren, die ein Schwefelatom enthalten. Der Wert von Cystein wird durch das Vorhandensein einer Sulfhydrylgruppe (-SH) in seiner Zusammensetzung bestimmt, die es ihm ermöglicht, leicht zu oxidieren und den Körper vor Substanzen mit hoher Oxidationsfähigkeit zu schützen (bei Strahlenschäden Phosphor Vergiftung). Methionin zeichnet sich durch das Vorhandensein einer leicht beweglichen Methylgruppe aus, die für die Synthese wichtiger Verbindungen im Körper (Cholin, Kreatin, Thymin, Adrenalin usw.)
Valin, Leucin und Isoleucin. Sie sind verzweigte Aminosäuren, die aktiv am Stoffwechsel beteiligt sind und nicht im Körper synthetisiert werden.
Monoaminodicarbonsäuren haben eine Amino- und zwei Carboxylgruppen und reagieren in wässriger Lösung sauer. Dazu gehören Asparagin und Glutamin, Asparagin und Glutamin. Sie gehören zu den inhibitorischen Mediatoren des Nervensystems.
Diaminomonocarbonsäuren reagieren in wässriger Lösung aufgrund der Anwesenheit von zwei Amingruppen alkalisch. Damit verwandt ist Lysin für die Synthese von Histonen und auch in einer Reihe von Enzymen notwendig. Arginin ist an der Synthese von Harnstoff und Kreatin beteiligt.
Zyklisch. Diese Aminosäuren haben in ihrer Zusammensetzung einen aromatischen oder heterocyclischen Kern und werden im menschlichen Körper in der Regel nicht synthetisiert und müssen mit der Nahrung zugeführt werden. Sie sind aktiv an einer Vielzahl von Stoffwechselvorgängen beteiligt. Phenylalanin dient also als Hauptquelle für die Synthese von Tyrosin - dem Vorläufer einer Reihe biologisch wichtiger Substanzen: Hormone (Thyroxin, Adrenalin), einige Pigmente. Tryptophan ist nicht nur an der Proteinsynthese beteiligt, sondern auch Bestandteil von Vitamin PP, Serotonin, Tryptamin und einer Reihe von Pigmenten. Histidin ist für die Synthese von Proteinen notwendig, ist ein Vorläufer von Histamin, das den Blutdruck und die Sekretion von Magensaft beeinflusst.
KAPITEL 4. STRUKTUR
Bei der Untersuchung der Zusammensetzung von Proteinen wurde festgestellt, dass sie alle nach einem einzigen Prinzip aufgebaut sind und vier Organisationsebenen haben: primär, sekundär, tertiär, und einige von ihnen Quartär Strukturen.
4.1 Primärstruktur
Es ist eine lineare Kette von Aminosäuren, die in einer bestimmten Reihenfolge angeordnet und durch Peptidbindungen miteinander verbunden sind. Peptidbindung gebildet durch die -Carboxylgruppe einer Aminosäure und die -Amingruppe einer anderen:
Die Peptidbindung aufgrund der p, -Konjugations -Bindung der Carbonylgruppe und des p-Orbitals des N-Atoms, auf dem sich das freie Elektronenpaar befindet, kann nicht als eine einzige betrachtet werden und es findet praktisch keine Rotation herum statt es. Aus dem gleichen Grund liegen das chirale Atom C und das Carbonylatom Ck jedes i-ten Aminosäurerests der Peptidkette und die N- und C-Atome des (i+1)-ten Rests in derselben Ebene. Das Carbonyl-O-Atom und das Amid-H-Atom befinden sich in derselben Ebene (jedoch zeigt das bei der Untersuchung der Struktur von Proteinen gesammelte Material, dass diese Aussage nicht ganz streng ist: Die mit dem Peptid-Stickstoffatom verbundenen Atome befinden sich nicht in der dieselbe Ebene damit, bilden aber eine dreiflächige Pyramide mit Winkeln zwischen den Bindungen, die sehr nahe bei 120 liegen. Daher zwischen den Ebenen, die von den Atomen C i , C i k , O i und N i +1 , H i +1 , C i + gebildet werden 1 , gibt es einen Winkel, der von 0 abweicht. Aber in der Regel überschreitet er 1 nicht und spielt keine besondere Rolle). Daher kann die Polypeptidkette geometrisch als aus solchen flachen Fragmenten gebildet angesehen werden, die jeweils sechs Atome enthalten. Die gegenseitige Anordnung dieser Fragmente muss wie jede gegenseitige Anordnung zweier Ebenen durch zwei Winkel bestimmt werden. Daher ist es üblich, Torsionswinkel zu nehmen, die Drehungen um N C - und C C k -Bindungen charakterisieren.
Die Geometrie jedes Moleküls wird durch drei Gruppen geometrischer Eigenschaften seiner chemischen Bindungen bestimmt - Bindungslängen, Bindungswinkel und Torsionswinkel zwischen Bindungen benachbarter Atome. Die ersten beiden Gruppen werden maßgeblich durch die Art der beteiligten Atome und der gebildeten Bindungen bestimmt. Daher wird die räumliche Struktur von Polymeren hauptsächlich durch die Torsionswinkel zwischen den Gliedern des Polymerrückgrats der Moleküle bestimmt, d. h. Polymerkettenkonformation. Dass R sionswinkel , d.h. Drehwinkel der A-B-Verbindung um die B-C-Verbindung relativ zur C-VerbindungD, ist definiert als der Winkel zwischen den Ebenen, die die Atome A, B, C und Atome enthaltenB, C, D.
In einem solchen System ist es möglich, dass die A-B- und C-D-Bindungen parallel angeordnet sind und sich auf derselben Seite der B-C-Bindung befinden. Wenn wir dieses System entlang der betrachtenichzi B-C, dann verdeckt die Verbindung A-B sozusagen die VerbindungC- D, so heißt diese KonformationsVaetsyaverdeckt. Gemäß den Empfehlungen der internationalen Chemieverbände IUPAC (International Union of Pure and Applied Chemistry) und IUB (International Union of Biochemistry) gilt der Winkel zwischen den ABC- und BCD-Ebenen als positiv, um die Konformation in a zu bringen verfinsterten Zustand durch Drehen um einen Winkel von nicht mehr als 180, am nächsten zum Beobachter Verbindung muss im Uhrzeigersinn gedreht werden. Wenn diese Bindung gegen den Uhrzeigersinn gedreht werden muss, um eine verdunkelte Konformation zu erhalten, wird der Winkel als negativ betrachtet. Es ist ersichtlich, dass diese Definition nicht davon abhängt, welche der Bindungen dem Beobachter näher ist.
In diesem Fall ist, wie aus der Figur ersichtlich, die Orientierung des Fragments, das die Atome C i -1 und C i enthält [(i-1)-tes Fragment], und des Fragments, das die Atome C i und C i + enthält 1 (i-tes Fragment), wird durch die Torsionswinkel bestimmt, die der Drehung um die Bindung N i C i und die Bindung C i C i k entsprechen. Diese Winkel werden üblicherweise mit und im gegebenen Fall mit i bzw. i bezeichnet. Ihre Werte für alle Monomereinheiten der Polypeptidkette bestimmen hauptsächlich die Geometrie dieser Kette. Es gibt weder für den Wert jedes dieser Winkel noch für ihre Kombinationen eindeutige Werte, obwohl beiden Beschränkungen auferlegt werden, die sowohl durch die Eigenschaften der Peptidfragmente selbst als auch durch die Art der Seitenradikale bestimmt werden, d.h. die Natur der Aminosäurereste.
Bis heute wurden Aminosäuresequenzen für mehrere tausend verschiedene Proteine etabliert. Das Erfassen der Struktur von Proteinen in Form detaillierter Strukturformeln ist umständlich und nicht visuell. Daher wird eine abgekürzte Schreibweise verwendet - drei Buchstaben oder ein Buchstabe (Vasopressin-Molekül):
Bei der Schreibweise einer Aminosäuresequenz in Polypeptid- oder Oligopeptidketten mit abgekürzten Symbolen wird, sofern nicht anders angegeben, davon ausgegangen, dass sich die α-Aminogruppe links und die α-Carboxylgruppe rechts befindet. Die entsprechenden Abschnitte der Polypeptidkette werden als N-Terminus (Aminende) und C-Terminus (Carboxylende) bezeichnet, und die Aminosäurereste werden als N-terminale bzw. C-terminale Reste bezeichnet.
4.2 Sekundärstruktur
Als Elemente der Sekundärstruktur werden Fragmente der räumlichen Struktur eines Biopolymers mit einer periodischen Struktur des Polymerrückgrats angesehen.
Wenn über einen bestimmten Abschnitt der Kette die gleiche Art von Winkeln, die auf Seite 15 erwähnt wurden, ungefähr gleich sind, dann bekommt die Struktur der Polypeptidkette einen periodischen Charakter. Es gibt zwei Klassen solcher Strukturen - spiralförmig und gestreckt (flach oder gefaltet).
Spiral Betrachtet wird eine Struktur, bei der alle gleichartigen Atome auf der gleichen Helix liegen. In diesem Fall gilt die Spirale als rechts, wenn sie sich entlang der Spiralachse im Uhrzeigersinn vom Betrachter wegbewegt, und als links, wenn sie sich gegen den Uhrzeigersinn wegbewegt. Die Polypeptidkette hat eine helikale Konformation, wenn alle C-Atome auf einer Helix, alle Carbonylatome C k - auf der anderen, alle N-Atome - auf der dritten liegen und die Helixganghöhe für alle drei Atomgruppen gleich sein sollte. Auch die Anzahl der Atome pro Windung der Helix muss gleich sein, egal ob es sich um Atome C k , C oder N handelt. Der Abstand zur gemeinsamen Helix ist bei jeder dieser drei Atomsorten unterschiedlich.
Die Hauptelemente der Sekundärstruktur von Proteinen sind -Helices und -Falten.
Helikale Proteinstrukturen. Für Polypeptidketten sind mehrere unterschiedliche Arten von Helices bekannt. Unter ihnen ist die rechtsgängige Helix am häufigsten. Die ideale -Helix hat eine Ganghöhe von 0,54 nm und die Anzahl gleichartiger Atome pro Helixwindung beträgt 3,6, was eine vollständige Periodizität bei fünf Windungen der Helix alle 18 Aminosäurereste bedeutet. Die Werte der Torsionswinkel für eine ideale α-Helix = - 57 = - 47, und die Abstände der Atome, die die Polypeptidkette bilden, zur Achse der Helix betragen 0,15 nm für N, 0,23 nm für C und 0,17 nm für C k . Jede Konformation existiert, vorausgesetzt, es gibt Faktoren, die sie stabilisieren. Im Fall einer Helix sind solche Faktoren die Wasserstoffbrückenbindungen, die von jedem Carbonylatom des (i + 4)-ten Fragments gebildet werden. Ein wichtiger Faktor bei der Stabilisierung der α-Helix ist auch die parallele Ausrichtung der Dipolmomente von Peptidbindungen.
Gefaltete Proteinstrukturen. Eines der häufigsten Beispiele für die gefaltete periodische Struktur eines Proteins ist die sogenannte. -faltet, bestehend aus zwei Fragmenten, die jeweils durch ein Polypeptid repräsentiert werden.
Falten werden auch durch Wasserstoffbrückenbindungen zwischen dem Wasserstoffatom der Amingruppe eines Fragments und dem Sauerstoffatom der Carboxylgruppe eines anderen Fragments stabilisiert. Dabei können die Fragmente sowohl parallel als auch antiparallel zueinander orientiert sein.
Die aus solchen Wechselwirkungen resultierende Struktur ist eine gewellte Struktur. Dies beeinflusst die Werte der Torsionswinkel und. Wenn sie in einer flachen, vollständig gestreckten Struktur 180 betragen sollten, haben sie in echten β-Schichten die Werte \u003d - 119 und \u003d + 113. ein Abschnitt, der eine Struktur aufweist, die sich stark von einer periodischen unterscheidet.
4.2.1 Faktoren, die die Sekundärstrukturbildung beeinflussen
Die Struktur eines bestimmten Abschnitts der Polypeptidkette hängt wesentlich von der Struktur des gesamten Moleküls ab. Die Einflussfaktoren auf die Bildung von Arealen mit einer bestimmten Sekundärstruktur sind sehr vielfältig und längst nicht in allen Fällen vollständig identifiziert. Es ist bekannt, dass eine Reihe von Aminosäureresten vorzugsweise in α-helikalen Fragmenten vorkommen, eine Reihe anderer - in α-Falten, einige Aminosäuren - hauptsächlich in Regionen ohne periodische Struktur. Die Sekundärstruktur wird weitgehend durch die Primärstruktur bestimmt. In einigen Fällen kann die physikalische Bedeutung einer solchen Abhängigkeit aus einer stereochemischen Analyse der räumlichen Struktur verstanden werden. Beispielsweise werden, wie aus der Figur ersichtlich, nicht nur Seitenreste von entlang der Kette benachbarten Aminosäureresten in der -Helix zusammengeführt, sondern zunächst jeweils einige Restepaare, die sich auf benachbarten Windungen der Helix befinden (i + 1)-ter Rest mit (i + 4)-ter und mit (i+5)-ter. Daher treten in den Positionen (i + 1) und (i + 2), (i + 1) und (i + 4), (i + 1) und (i + 5) -Helices selten zwei sperrige Reste gleichzeitig auf, wie z wie beispielsweise als Seitenreste von Tyrosin, Tryptophan, Isoleucin. Noch weniger kompatibel mit der Helixstruktur ist das gleichzeitige Vorhandensein von drei voluminösen Resten in den Positionen (i+1), (i+2) und (i+5) oder (i+1), (i+4) und (i+). 5). Daher sind solche Kombinationen von Aminosäuren in α-helikalen Fragmenten seltene Ausnahmen.
4.3 Tertiärstruktur
Dieser Begriff bezieht sich auf die vollständige räumliche Faltung der gesamten Polypeptidkette, einschließlich der Faltung von Seitenresten. Ein vollständiges Bild der Tertiärstruktur ergibt sich aus den Koordinaten aller Atome des Proteins. Dank des enormen Erfolgs der Röntgenbeugungsanalyse wurden solche Daten mit Ausnahme der Koordinaten von Wasserstoffatomen für eine beträchtliche Anzahl von Proteinen erhalten. Das sind riesige Mengen an Informationen, die in speziellen Datenbanken auf maschinenlesbaren Medien gespeichert sind und deren Verarbeitung ohne den Einsatz von Hochgeschwindigkeitsrechnern undenkbar ist. Am Computer erhaltene Atomkoordinaten liefern vollständige Informationen über die Geometrie der Polypeptidkette, einschließlich der Werte der Torsionswinkel, die es ermöglichen, eine helikale Struktur, Falten oder unregelmäßige Fragmente aufzudecken. Ein Beispiel für einen solchen Forschungsansatz ist das folgende räumliche Modell der Struktur des Enzyms Phosphoglyceratkinase:
Allgemeines Schema der Struktur von Phosphoglyceratkinase. Zur Verdeutlichung sind die α-helikalen Abschnitte als Zylinder und die α-Falten als Bänder mit einem Pfeil dargestellt, der die Richtung der Kette vom N-Terminus zum C-Terminus angibt. Linien sind unregelmäßige Abschnitte, die strukturierte Fragmente verbinden.
Das Bild der vollständigen Struktur selbst eines kleinen Proteinmoleküls auf einer Ebene, sei es eine Buchseite oder ein Bildschirm, ist aufgrund der äußerst komplexen Struktur des Objekts nicht sehr aussagekräftig. Damit die Forscher die räumliche Struktur der Moleküle komplexer Substanzen visualisieren können, nutzen sie Methoden der dreidimensionalen Computergrafik, die es ermöglichen, einzelne Teile der Moleküle darzustellen und zu manipulieren, insbesondere zu drehen rechte Winkel.
Die Tertiärstruktur wird als Ergebnis nichtkovalenter Wechselwirkungen (elektrostatische, ionische, Van-der-Waals-Kräfte usw.) von Seitenradikalen gebildet, die α-Helices und -Falten und nichtperiodische Fragmente der Polypeptidkette einrahmen. Unter den Bindungen, die die Tertiärstruktur halten, sollte beachtet werden:
a) Disulfidbrücke (- S - S -)
b) Esterbrücke (zwischen Carboxylgruppe und Hydroxylgruppe)
c) Salzbrücke (zwischen Carboxylgruppe und Aminogruppe)
d) Wasserstoffbrückenbindungen.
Entsprechend der Form des Proteinmoleküls aufgrund der Tertiärstruktur werden folgende Proteingruppen unterschieden:
globuläre Proteine. Die räumliche Struktur dieser Proteine lässt sich in grober Näherung als Kugel oder als nicht zu langgestrecktes Ellipsoid darstellen - Kugelbeily. In der Regel bildet ein erheblicher Teil der Polypeptidkette solcher Proteine β-Helices und β-Falten. Das Verhältnis zwischen ihnen kann sehr unterschiedlich sein. Zum Beispiel bei Myoglobin(mehr dazu auf Seite 28) es gibt 5 spiralförmige Segmente und keine einzige Falte. Bei Immunglobulinen (Näheres auf S. 42) hingegen sind die Hauptelemente der Sekundärstruktur -Falten, und -Helices fehlen vollständig. In der obigen Struktur der Phosphoglyceratkinase werden beide Strukturtypen ungefähr gleich dargestellt. In manchen Fällen sind, wie am Beispiel der Phosphoglyceratkinase zu sehen, zwei oder mehr räumlich deutlich getrennte (aber natürlich trotzdem durch Peptidbrücken verbundene) Teile deutlich sichtbar - Domänen. Häufig werden unterschiedliche funktionelle Regionen eines Proteins in unterschiedliche Domänen aufgeteilt.
fibrilläre Proteine. Diese Proteine haben eine längliche fadenförmige Form und erfüllen eine strukturelle Funktion im Körper. Sie haben in der Primärstruktur sich wiederholende Abschnitte und bilden eine ziemlich einheitliche Sekundärstruktur für die gesamte Polypeptidkette. So wird das Protein - Kreatin (der Hauptproteinbestandteil von Nägeln, Haaren, Haut) aus verlängerten - Spiralen aufgebaut. Seidenfibroin besteht aus sich periodisch wiederholenden Fragmenten Gly - Ala - Gly - Ser, die Falten bilden. Es gibt weniger häufig vorkommende Elemente der Sekundärstruktur, beispielsweise Kollagen-Polypeptidketten, die sich bilden linke Spiralen mit Parametern, die sich stark von denen von -Helices unterscheiden. In Kollagenfasern sind drei helikale Polypeptidketten zu einer einzigen rechten Superspirale verdrillt:
4.4 Quartäre Struktur
In den meisten Fällen ist es für das Funktionieren von Proteinen erforderlich, dass mehrere Polymerketten zu einem einzigen Komplex kombiniert werden. Ein solcher Komplex wird auch als Protein angesehen, das aus mehreren besteht Untereinheiten. Die Untereinheitsstruktur erscheint in der wissenschaftlichen Literatur häufig als Quartärstruktur.
Proteine, die aus mehreren Untereinheiten bestehen, sind in der Natur weit verbreitet. Ein klassisches Beispiel ist die Quartärstruktur von Hämoglobin (mehr Details - S. 26). Untereinheiten werden normalerweise mit griechischen Buchstaben bezeichnet. Hämoglobin hat zwei und zwei Untereinheiten. Das Vorhandensein mehrerer Untereinheiten ist funktionell wichtig - es erhöht den Grad der Sauerstoffsättigung. Die Quartärstruktur von Hämoglobin wird als 2 2 bezeichnet.
Die Struktur der Untereinheit ist für viele Enzyme charakteristisch, vor allem für solche, die komplexe Funktionen ausführen. B. RNA-Polymerase aus E. coli hat eine Untereinheitsstruktur 2 ", d.h. es ist aus vier verschiedenen Arten von Untereinheiten aufgebaut, und die -Untereinheit ist dupliziert. Dieses Protein erfüllt komplexe und vielfältige Funktionen - es initiiert DNA, bindet Substrate - Ribonukleosidtriphosphate und überträgt auch Nukleotidreste auf a wachsende Polyribonukleotidkette und einige andere Funktionen.
Die Arbeit vieler Proteine unterliegt der sogenannten. Allosterische Regulation- spezielle Verbindungen (Effektoren) „schalten“ oder „schalten“ die Arbeit des aktiven Zentrums des Enzyms ein. Solche Enzyme haben spezielle Effektorerkennungsstellen. Und es gibt sogar besondere regulatorische Untereinheiten, die unter anderem die angegebenen Abschnitte umfassen. Ein klassisches Beispiel sind Proteinkinaseenzyme, die die Übertragung eines Phosphorsäurerests von einem ATP-Molekül auf Substratproteine katalysieren.
KAPITEL 5. EIGENSCHAFTEN
Proteine haben ein hohes Molekulargewicht, einige sind wasserlöslich, quellfähig, zeichnen sich durch optische Aktivität, Mobilität in einem elektrischen Feld und einige andere Eigenschaften aus.
Proteine sind aktiv an chemischen Reaktionen beteiligt. Diese Eigenschaft beruht darauf, dass die Aminosäuren, aus denen Proteine bestehen, verschiedene funktionelle Gruppen enthalten, die mit anderen Substanzen reagieren können. Es ist wichtig, dass solche Wechselwirkungen auch innerhalb des Proteinmoleküls stattfinden, was zur Bildung von Peptid-, Schwefelwasserstoff- und anderen Arten von Bindungen führt. An die Reste von Aminosäuren und damit von Proteinen können verschiedene Verbindungen und Ionen binden, die deren Transport durch das Blut gewährleisten.
Proteine sind makromolekulare Verbindungen. Dies sind Polymere, die aus Hunderten und Tausenden von Aminosäureresten - Monomeren - bestehen. Dementsprechend und molekulare Masse Proteine liegt im Bereich von 10 000 - 1 000 000. So enthält Ribonuklease (ein Enzym, das RNA abbaut) 124 Aminosäurereste und sein Molekulargewicht beträgt ungefähr 14 000. Myoglobin (Muskelprotein), bestehend aus 153 Aminosäureresten, hat ein Molekül Gewicht 17.000 und Hämoglobin - 64.500 (574 Aminosäurereste). Die Molekulargewichte anderer Proteine sind höher: -Globulin (bildet Antikörper) besteht aus 1250 Aminosäuren und hat ein Molekulargewicht von etwa 150.000, und das Molekulargewicht des Glutamat-Dehydrogenase-Enzyms übersteigt 1.000.000.
Die Bestimmung des Molekulargewichts wird durch verschiedene Methoden durchgeführt: osmometrische, Gelfiltration, optische usw. Die genaueste ist jedoch die von T. Svedberg vorgeschlagene Sedimentationsmethode. Es basiert auf der Tatsache, dass während der Ultrazentrifugation mit einer Beschleunigung von bis zu 900.000 g die Rate der Proteinfällung von ihrem Molekulargewicht abhängt.
Die wichtigste Eigenschaft von Proteinen ist ihre Fähigkeit, sowohl sauer als auch basisch zu sein, dh als zu wirken amphoter Elektrolyte. Dafür sorgen verschiedene dissoziierende Gruppen, aus denen die Aminosäurereste bestehen. Beispielsweise werden die sauren Eigenschaften des Proteins durch die Carboxylgruppen der Aspartat-Glutaminsäure-Aminosäure und die alkalischen Eigenschaften durch die Reste von Arginin, Lysin und Histidin verliehen. Je mehr Dicarbonsäuren ein Protein enthält, desto stärker sind seine sauren Eigenschaften und umgekehrt.
Diese Gruppen haben auch elektrische Ladungen, die die Gesamtladung des Proteinmoleküls bilden. In Proteinen, in denen Asparagin- und Glutamin-Aminosäuren vorherrschen, ist die Ladung des Proteins negativ; ein Überschuss an basischen Aminosäuren verleiht dem Proteinmolekül eine positive Ladung. Infolgedessen bewegen sich Proteine in einem elektrischen Feld in Abhängigkeit von der Größe ihrer Gesamtladung zur Kathode oder Anode. So gibt das Protein in alkalischem Milieu (pH 7 - 14) ein Proton ab und wird negativ geladen, während in saurem Milieu (pH 1 - 7) die Dissoziation von Säuregruppen unterdrückt wird und das Protein zu einem Kation wird.
Entscheidend für das Verhalten eines Proteins als Kation oder Anion ist also die Reaktion des Mediums, die durch die Konzentration an Wasserstoffionen bestimmt und durch den pH-Wert ausgedrückt wird. Bei bestimmten pH-Werten gleicht sich jedoch die Anzahl positiver und negativer Ladungen an und das Molekül wird elektrisch neutral, d.h. es bewegt sich nicht in einem elektrischen Feld. Dieser pH-Wert des Mediums wird als isoelektrischer Punkt von Proteinen bezeichnet. In diesem Fall befindet sich das Protein im instabilsten Zustand und fällt bei leichten Änderungen des pH-Werts zur sauren oder alkalischen Seite leicht aus. Bei den meisten natürlichen Proteinen liegt der isoelektrische Punkt in einer leicht sauren Umgebung (pH 4,8 - 5,4), was auf das Vorherrschen von Dicarbonsäureaminosäuren in ihrer Zusammensetzung hinweist.
Die amphotere Eigenschaft liegt den Puffereigenschaften von Proteinen und ihrer Beteiligung an der Regulierung des Blut-pH-Werts zugrunde. Der pH-Wert des menschlichen Blutes ist konstant und liegt trotz verschiedener Stoffe saurer oder basischer Natur, die regelmäßig mit der Nahrung zugeführt oder bei Stoffwechselprozessen gebildet werden, im Bereich von 7,36 - 7,4 - daher gibt es spezielle Mechanismen zur Regulation des Säure-Basen-Verhältnisses Gleichgewicht der inneren Umgebung des Körpers. Zu solchen Systemen gehört das in Kap. Hämoglobin-Puffersystem „Klassifizierung“ (Seite 28). Eine Änderung des Blut-pH um mehr als 0,07 weist auf die Entwicklung eines pathologischen Prozesses hin. Eine Verschiebung des pH-Werts zur sauren Seite wird als Azidose und zur alkalischen Seite als Alkalose bezeichnet.
Von großer Bedeutung für den Körper ist die Fähigkeit von Proteinen, an ihrer Oberfläche bestimmte Stoffe und Ionen (Hormone, Vitamine, Eisen, Kupfer) zu adsorbieren, die entweder schlecht wasserlöslich oder giftig sind (Bilirubin, freie Fettsäuren). Proteine transportieren sie durch das Blut zu Orten weiterer Umwandlungen oder Neutralisierungen.
Wässrige Lösungen von Proteinen haben ihre eigenen Eigenschaften. Erstens haben Proteine eine hohe Affinität zu Wasser, d.h. sie hydrophil. Das bedeutet, dass Proteinmoleküle wie geladene Teilchen Wasserdipole anziehen, die sich um das Proteinmolekül herum befinden und eine Wasser- oder Hydrathülle bilden. Diese Hülle schützt die Proteinmoleküle vor dem Zusammenkleben und Ausfällen. Die Größe der Hydrathülle hängt von der Struktur des Proteins ab. Beispielsweise binden Albumine leichter an Wassermoleküle und haben eine relativ große Wasserhülle, während Globuline und Fibrinogen Wasser schlechter binden und die Hydratationshülle kleiner ist. Somit wird die Stabilität einer wässrigen Lösung eines Proteins durch zwei Faktoren bestimmt: das Vorhandensein einer Ladung auf dem Proteinmolekül und der es umgebenden Wasserhülle. Wenn diese Faktoren entfernt werden, fällt das Protein aus. Dieser Prozess kann reversibel und irreversibel sein.
...Ähnliche Dokumente
Eiweiße (Eiweiße) sind hochmolekulare, stickstoffhaltige organische Naturstoffe, deren Moleküle aus Aminosäuren aufgebaut sind. Die Struktur von Proteinen. Klassifizierung von Proteinen. Physikalisch-chemische Eigenschaften von Proteinen. Biologische Funktionen von Proteinen. Enzym.
Zusammenfassung, hinzugefügt am 15.05.2007
Die Hauptmerkmale von Stoffwechselprozessen. Stoffwechsel und Energie. Allgemeine Merkmale, Klassifizierung, Funktionen, chemische Zusammensetzung und Eigenschaften von Proteinen, ihre biologische Rolle beim Aufbau lebender Materie. Strukturelle und komplexe Proteine. Methoden zu ihrer Fällung.
Präsentation, hinzugefügt am 24.04.2013
Physikalische und chemische Eigenschaften, Farbreaktionen von Proteinen. Zusammensetzung und Struktur, Funktionen von Proteinen in der Zelle. Ebenen der Proteinstruktur. Hydrolyse von Proteinen, ihre Transport- und Schutzfunktion. Protein als Baustoff der Zelle, sein Energiewert.
Zusammenfassung, hinzugefügt am 18.06.2010
Physikalische, biologische und chemische Eigenschaften von Proteinen. Synthese und Analyse von Proteinen. Bestimmung der Primär-, Sekundär-, Tertiär- und Quartärstruktur von Proteinen. Denaturierung, Isolierung und Reinigung von Proteinen. Die Verwendung von Proteinen in Industrie und Medizin.
Zusammenfassung, hinzugefügt am 10.06.2015
Proteine - organische Verbindungen mit hohem Molekulargewicht, ihre Aminosäurezusammensetzung. Bestimmung der Eigenschaften von Proteinen anhand ihrer Zusammensetzung und Struktur des Proteinmoleküls. Charakterisierung der Hauptfunktionen von Proteinen. Zellorganellen und ihre Funktionen. Zellatmung und ihre Struktur.
Test, hinzugefügt am 24.06.2012
Das Konzept und die Struktur von Proteinen, Aminosäuren als ihre Monomere. Klassifizierung und Sorten von Aminosäuren, die Art der Peptidbindung. Organisationsebenen eines Proteinmoleküls. Chemische und physikalische Eigenschaften von Proteinen, Methoden zu ihrer Analyse und ihre Funktionen.
Präsentation, hinzugefügt am 14.04.2014
Die biologische Rolle des Wassers. Funktionen von Mineralsalzen. Einfache und komplexe Lipide. Organisationsebenen von Proteinen. Aufbau, Energie, Speicher und regulatorische Funktionen von Lipiden. Strukturelle, katalytische, motorische, Transportfunktionen von Proteinen.
Präsentation, hinzugefügt am 21.05.2015
Aminosäurezusammensetzung von Proteinen in Organismen, die Rolle des genetischen Codes. Kombinationen von 20 Standard-Aminosäuren. Trennung von Proteinen in eine separate Klasse biologischer Moleküle. Hydrophile und hydrophobe Proteine. Das Prinzip des Aufbaus von Proteinen, die Ebene ihrer Organisation.
kreative Arbeit, hinzugefügt am 08.11.2009
Grundelemente und chemische Zusammensetzung des Muskelgewebes. Arten von Proteinen von Sarkoplasma und Myofibrillen, ihr Gehalt an der Gesamtzahl von Proteinen, Molekulargewicht, Verteilung in den Strukturelementen des Muskels. Ihre Funktionen und Rolle im Körper. Die Struktur des Myosinmoleküls.
Präsentation, hinzugefügt am 14.12.2014
Proteine als Nahrungsquellen, ihre Hauptfunktionen. Aminosäuren, die an der Herstellung von Proteinen beteiligt sind. Die Struktur der Polypeptidkette. Umwandlung von Proteinen im Körper. Vollständige und unvollständige Proteine. Proteinstruktur, chemische Eigenschaften, qualitative Reaktionen.
Ministerium für Bildung und Wissenschaft der Russischen Föderation
Bundesamt für Bildung
Staatliche Südural-Universität
Abteilung für Warenkunde und Expertise von Konsumgütern
KURSARBEIT
in der Disziplin "Rohstoffforschung, -prüfung und -normung"
zum Thema „Untersuchung der Elemente der chemischen Zusammensetzung von Lebensmitteln (am Beispiel von Proteinen)“
Abgeschlossen:
Abidullina Eleonora
Gruppe Kom-234
Geprüft von: Cherkasova Elvira Vyacheslavovna
Tscheljabinsk
| Einführung………………………………………………………………………. |
|
| 1. Literaturübersicht |
|
| 1.1. Allgemeine Konzepte über Proteine |
|
| 1.1.1. Die chemische Natur von Proteinen ………………………………..... |
|
| 1.1.2. Klassifizierung von Proteinen ……………………………………….. |
|
| 1.1.3. Eigenschaften von Proteinen ………………………………………………. |
|
| 1.2. Der Einfluss von Proteinen auf den menschlichen Körper……………………………. |
|
| 1.3. Veränderungen des Proteingehalts während der technologischen Verarbeitung……………………………………………………………………... |
|
| 1.4. Änderungen des Proteingehalts während der Lagerung ……………………. |
|
| 2. Praktischer Teil |
|
| 2.1. Charakterisierung quantitativer Methoden zur Bestimmung des Proteingehalts ………………………………………………………………. |
|
| 2.2. Merkmale qualitativer Methoden zur Bestimmung des Proteingehalts ………………………………………………………………………………. |
|
| 3. Experimenteller Teil |
|
| 3.1. Begründung für die Wahl des Studiengegenstandes ………………………. |
|
| 3.2. Analyse der Ergebnisse eigener Recherchen………………….. |
|
| Fazit…………………………………………………………………………... |
|
| Referenzliste…………………………………………………………… |
|
| Anwendung…………………………………………………………………… |
Einführung
Proteine sind der wichtigste Kunststoff für das Wachstum, die Entwicklung und die Erneuerung des Körpers. Sie sind die Hauptstrukturelemente aller Gewebe und Teil der flüssigen Umgebung des Körpers. Nahrungsproteine werden für den Aufbau von roten Blutkörperchen und Hämoglobin, Enzymen und Hormonen ausgegeben und sind aktiv an der Entwicklung von Schutzfaktoren - Antikörpern - beteiligt.
Bei zu geringem Proteingehalt in der Ernährung können sich im Körper schwere Störungen (Hypotrophie, Anämie etc.) entwickeln, häufiger treten akute Atemwegserkrankungen auf, die einen langwierigen Verlauf nehmen. Allerdings kann zu viel Protein der Gesundheit schaden. Bei längerer Einnahme von proteinreichen Lebensmitteln leidet die Nieren- und Leberfunktion, die nervöse Erregbarkeit nimmt zu, es treten häufig allergische Reaktionen auf, Vergiftungen sind durch unvollständigen Abbau und Oxidation von Proteinen unter Bildung toxischer Substanzen möglich.
Die typischste Ursache für eine unausgewogene Ernährung ist ein unzureichender Verzehr der wichtigsten Quellen für vollständiges tierisches Protein (Fleisch, Fisch, Milch, Eier), Pflanzenöle, frisches Gemüse und Obst.
Daher ist die Untersuchung der Elemente der chemischen Zusammensetzung von Lebensmitteln und insbesondere von Proteinen heute nicht nur wichtig, sondern auch sehr aktuell.
Ziel der Arbeit ist es, die Bedeutung von Proteinen für den menschlichen Körper und die Hauptquellen von Proteinen zu identifizieren.
Im Zuge dieser Arbeit werden folgende Hauptaufgaben gestellt: das Studium der chemischen Zusammensetzung von Proteinen, ihre Wirkung auf den menschlichen Körper, die Probleme der Verarbeitung und Speicherung von Proteinen, ihre Eigenschaften, das Studium von Methoden zur Untersuchung des Proteingehalts in Lebensmitteln, Überprüfung, ob der tatsächliche Proteingehalt im Produkt normalisiert ist.
1. Literaturübersicht
1.1. Allgemeine Konzepte über Proteine
1.1.1. Chemische Natur von Proteinen
Peptidbindung
Proteine sind unregelmäßige Polymere, die aus Aminosäureresten aufgebaut sind, deren allgemeine Formel in einer wässrigen Lösung bei pH-Werten nahe dem Neutralpunkt als NH3 + CHRCOO – geschrieben werden kann. Aminosäurereste in Proteinen sind durch eine Amidbindung zwischen Amino- und Carboxylgruppen miteinander verbunden. Eine Peptidbindung zwischen zwei Aminosäureresten wird üblicherweise als Peptidbindung bezeichnet, und Polymere, die aus Aminosäureresten aufgebaut sind, die durch Peptidbindungen verbunden sind, werden als Polypeptide bezeichnet. Ein Protein als biologisch bedeutsame Struktur kann entweder ein einzelnes Polypeptid oder mehrere Polypeptide sein, die durch nicht-kovalente Wechselwirkungen einen einzigen Komplex bilden.
Elementare Zusammensetzung von Proteinen
Um die chemische Zusammensetzung von Proteinen zu untersuchen, muss man erstens herausfinden, aus welchen chemischen Elementen sie bestehen, und zweitens die Struktur ihrer Monomere. Zur Beantwortung der ersten Frage wird die quantitative und qualitative Zusammensetzung der chemischen Elemente des Proteins bestimmt. Die chemische Analyse zeigte das Vorhandensein von Kohlenstoff (50–55 %), Sauerstoff (21–23 %), Stickstoff (15–17 %), Wasserstoff (6–7 %) und Schwefel (0,3–2,5 %) in allen Proteinen. Auch Phosphor, Jod, Eisen, Kupfer und einige andere Makro- und Spurenelemente wurden in unterschiedlichen, oft sehr geringen Mengen in der Zusammensetzung einzelner Proteine gefunden.
Der Gehalt der wichtigsten chemischen Elemente in Proteinen kann variieren, mit Ausnahme von Stickstoff, dessen Konzentration durch die größte Konstanz gekennzeichnet ist und durchschnittlich 16% beträgt. Außerdem ist der Stickstoffgehalt in anderen organischen Stoffen gering. In Übereinstimmung damit wurde vorgeschlagen, die Proteinmenge durch ihren Bestandteil Stickstoff zu bestimmen. Da in 6,25 g Protein 1 g Stickstoff enthalten ist, wird die gefundene Stickstoffmenge mit dem Faktor 6,25 multipliziert und man erhält die Proteinmenge.
Um die chemische Natur von Proteinmonomeren zu bestimmen, müssen zwei Probleme gelöst werden: das Protein in Monomere zu trennen und ihre chemische Zusammensetzung herauszufinden. Der Abbau eines Proteins in seine Bestandteile erfolgt durch Hydrolyse – längeres Kochen des Proteins mit starken Mineralsäuren (saure Hydrolyse) oder Basen (alkalische Hydrolyse). Am häufigsten wird das Kochen bei 110°C mit HCl für 24 Stunden verwendet.Im nächsten Schritt werden die Substanzen, aus denen das Hydrolysat besteht, getrennt. Dazu kommen verschiedene Methoden zum Einsatz, am häufigsten die Chromatographie (näheres dazu im Kapitel „Forschungsmethoden ...“). Aminosäuren sind der Hauptteil der abgetrennten Hydrolysate.
Aminosäuren
Derzeit wurden bis zu 200 verschiedene Aminosäuren in verschiedenen Objekten der Tierwelt gefunden. Im menschlichen Körper gibt es zum Beispiel etwa 60. Proteine enthalten jedoch nur 20 Aminosäuren, die manchmal als natürliche Aminosäuren bezeichnet werden.
Aminosäuren sind organische Säuren, bei denen das Wasserstoffatom des Kohlenstoffatoms durch eine Aminogruppe - NH2 - ersetzt ist. Chemisch gesehen handelt es sich also um Aminosäuren mit der allgemeinen Formel:
Aus dieser Formel ist ersichtlich, dass die Zusammensetzung aller Aminosäuren die folgenden allgemeinen Gruppen umfasst: - CH2, - NH2, - COOH. Seitenketten (Radikale - R) von Aminosäuren unterscheiden sich. Die chemische Natur von Radikalen ist vielfältig: vom Wasserstoffatom bis zu zyklischen Verbindungen. Es sind die Radikale, die die strukturellen und funktionellen Eigenschaften von Aminosäuren bestimmen.
Alle Aminosäuren, mit Ausnahme der einfachsten Aminosäure Glycin (NH3 + CH2COO-), haben ein chirales Ca-Atom und können in Form von zwei Enantiomeren (optischen Isomeren) vorliegen: L-Isomer und D-Isomer.
Proteine werden aus den zwanzig grundlegenden Aminosäuren aufgebaut, aber die restlichen, ziemlich unterschiedlichen Aminosäuren werden aus diesen 20 Aminosäureresten bereits in der Zusammensetzung des Proteinmoleküls gebildet. Unter diesen Transformationen ist vor allem die Bildung von Disulfidbrücken während der Oxidation zweier Cysteinreste in der Zusammensetzung bereits gebildeter Peptidketten zu erwähnen. Dadurch wird aus zwei Cysteinresten ein Diaminodicarbonsäure-Cystinrest gebildet. In diesem Fall erfolgt die Vernetzung entweder innerhalb einer Polypeptidkette oder zwischen zwei verschiedenen Ketten. Als kleines Protein, das zwei durch Disulfidbrücken verbundene Polypeptidketten sowie Quervernetzungen innerhalb einer der Polypeptidketten aufweist:
GIVEQCCASVCSLYQLENYCN
FVNQHLCGSHLVEALYLVCGERGFFYTPKA
Aminosäuren in wässriger Lösung befinden sich aufgrund der Dissoziation von Amino- und Carboxylgruppen, aus denen die Radikale bestehen, in einem ionisierten Zustand. Mit anderen Worten, sie sind amphotere Verbindungen und können entweder als Säuren (Protonendonoren) oder als Basen (Donorakzeptoren) existieren.
Alle Aminosäuren werden je nach Struktur in mehrere Gruppen eingeteilt:
Azyklisch. Monoaminomonocarbonsäuren haben in ihrer Zusammensetzung eine Amino- und eine Carboxylgruppe, sie sind in wässriger Lösung neutral. Einige von ihnen haben gemeinsame strukturelle Merkmale, die es ermöglichen, sie zusammen zu betrachten:
1. Glycin und Alanin. Glycin (Glykokol oder Aminoessigsäure) ist optisch inaktiv – es ist die einzige Aminosäure, die keine Enantiomere hat. Glycin ist an der Bildung von Nukleinsäuren und Gallenflüssigkeit beteiligt - t, Häm, ist für die Neutralisierung toxischer Produkte in der Leber notwendig. Alanin wird vom Körper in verschiedenen Prozessen des Kohlenhydrat- und Energiestoffwechsels verwendet. Sein Isomer b-Alanin ist ein wesentlicher Bestandteil des Pantothensäure-Vitamins, Coenzym A (CoA), Muskelextraktionssubstanzen.
2. Serin und Threonin. Sie gehören zur Gruppe der Hydrohydroxysäuren, weil. eine Hydroxylgruppe haben. Serin ist Bestandteil verschiedener Enzyme, des Hauptproteins der Milch - Kasein sowie vieler Lipoproteine. Threonin ist als essentielle Aminosäure an der Proteinbiosynthese beteiligt.
3. Cystein und Methionin. Aminosäuren, die ein Schwefelatom enthalten. Der Wert von Cystein wird durch das Vorhandensein einer Sulfhydrylgruppe (-SH) in seiner Zusammensetzung bestimmt, die es ihm ermöglicht, leicht zu oxidieren und den Körper vor Substanzen mit hoher Oxidationsfähigkeit zu schützen (bei Strahlenschäden Phosphor Vergiftung). Methionin zeichnet sich durch das Vorhandensein einer leicht beweglichen Methylgruppe aus, die für die Synthese wichtiger Verbindungen im Körper (Cholin, Kreatin, Thymin, Adrenalin usw.)
4. Valin, Leucin und Isoleucin. Sie sind verzweigte Aminosäuren, die aktiv am Stoffwechsel beteiligt sind und nicht im Körper synthetisiert werden.
Monoaminodicarbonsäuren haben eine Amino- und zwei Carboxylgruppen und reagieren in wässriger Lösung sauer. Dazu gehören Asparagin und Glutamin, Asparagin und Glutamin. Sie gehören zu den inhibitorischen Mediatoren des Nervensystems.
Diaminomonocarbonsäuren reagieren in wässriger Lösung aufgrund der Anwesenheit von zwei Amingruppen alkalisch. Damit verwandt ist Lysin für die Synthese von Histonen und auch in einer Reihe von Enzymen notwendig. Arginin ist an der Synthese von Harnstoff und Kreatin beteiligt.
Zyklisch. Diese Aminosäuren haben in ihrer Zusammensetzung einen aromatischen oder heterocyclischen Kern und werden im menschlichen Körper in der Regel nicht synthetisiert und müssen mit der Nahrung zugeführt werden. Sie sind aktiv an einer Vielzahl von Stoffwechselvorgängen beteiligt. Somit dient Phenylalanin als Hauptquelle für die Synthese von Tyrosin, einem Vorläufer einer Reihe biologisch wichtiger Substanzen: Hormone (Thyroxin, Adrenalin) und einiger Pigmente. Tryptophan ist nicht nur an der Proteinsynthese beteiligt, sondern auch Bestandteil von Vitamin PP, Serotonin, Tryptamin und einer Reihe von Pigmenten. Histidin ist für die Synthese von Proteinen notwendig, ist ein Vorläufer von Histamin, das den Blutdruck und die Sekretion von Magensaft beeinflusst.
1.1.2. Proteinklassifizierung
Alle Proteine werden je nach Struktur in einfache - Proteine, die nur aus Aminosäuren bestehen, und komplexe - Proteine unterteilt, die eine nicht-proteinische Proteingruppe haben.
Proteine
Proteine sind einfache Proteine, die nur aus dem Proteinanteil bestehen. Sie sind in der Tier- und Pflanzenwelt weit verbreitet. Dazu gehören Albumine und Globuline, die in fast allen tierischen und pflanzlichen Zellen, biologischen Flüssigkeiten vorkommen und wichtige biologische Funktionen erfüllen. Albumine sind an der Aufrechterhaltung des osmotischen Drucks des Blutes beteiligt (erzeugen onkotischen Druck), transportieren verschiedene Substanzen mit dem Blut. Globuline sind Teil der Enzyme, die die Basis von Immunglobulinen bilden, die als Antikörper wirken. Im Blutserum besteht ein konstantes Verhältnis zwischen diesen beiden Komponenten - dem Albumin-Globulin-Koeffizienten (A / G), der 1,7 - 2,3 entspricht und einen wichtigen diagnostischen Wert hat.
Weitere Vertreter der Proteine sind Protamine und Histone – basische Proteine, die viel Lysin und Arginin enthalten. Diese Proteine gehören zu den Nukleoproteinen. Ein weiteres wichtiges Protein, Kollagen, bildet die extrazelluläre Substanz des Bindegewebes und kommt in Haut, Knorpel und anderen Geweben vor.
Proteine
Proteine sind komplexe Proteine, die aus Protein- und Nichtproteinteilen bestehen. Der Name des Proteins wird durch den Namen seiner prosthetischen Gruppe bestimmt. Nukleinsäuren sind also ein Nicht-Protein-Teil von Nukleoproteinen, Phosphorsäure ist Teil von Phosphoproteinen, Kohlenhydrate sind Glykoproteine und Lipide sind Lipoproteine.
Nukleoproteine. Sie sind wichtig, weil ihr Nicht-Protein-Teil wird durch DNA und RNA dargestellt. Die prothetische Gruppe wird hauptsächlich durch Histone und Protamine repräsentiert. Solche DNA-Komplexe mit Histonen finden sich in Spermatozoen und mit Histone - in somatischen Zellen, wo das DNA-Molekül um Histonmoleküle „gewickelt“ ist. Nukleoproteine sind von Natur aus extrazelluläre Viren - dies sind Komplexe aus viraler Nukleinsäure und einer Proteinhülle - Kapsid.
Chromoproteine. Sie sind komplexe Proteine, deren prosthetische Gruppe durch farbige Verbindungen dargestellt wird. Zu den Chromoproteinen gehören Hämoglobin, Myoglobin (Muskelprotein), eine Reihe von Enzymen (Katalase, Peroxidase, Cytochrome) sowie Chlorophyll.
Hämoglobin (Hb) besteht aus einem Globinprotein und einem Nichtproteinteil des Häms, der ein mit Protoporphyrin verbundenes Fe(II)-Atom enthält. Das Hämoglobinmolekül besteht aus 4 Untereinheiten: zwei a und zwei b und enthält dementsprechend vier Polypeptidketten zweier Sorten. Jede a-Kette enthält 141 und b-Kette - 146 Aminosäurereste.
Myoglobin. Ein Chromoprotein, das in Muskeln vorkommt. Es besteht aus nur einer Kette, analog zur Untereinheit des Hämoglobins. Myoglobin ist das Atmungspigment im Muskelgewebe. Es bindet viel leichter an Sauerstoff als Hämoglobin, aber es ist schwieriger, ihn freizusetzen. Myoglobin schafft Sauerstoffreserven in den Muskeln, wo seine Menge 14% des Gesamtsauerstoffs des Körpers erreichen kann. Dies ist wichtig, insbesondere für die Arbeit der Herzmuskeln. Bei Meeressäugern (Robben, Walross) wurde ein hoher Myoglobingehalt festgestellt, der es ihnen ermöglicht, lange unter Wasser zu bleiben.
Glykoproteine. Sie sind komplexe Proteine, deren prosthetische Gruppe durch Derivate von Kohlenhydraten (Aminozucker, Hexuronsäuren) gebildet wird. Glykoproteine sind Bestandteile von Zellmembranen. So werden die Lungenwände von Bakterien aus Peptidoglykanen aufgebaut, die Derivate von linearen Polysacchariden sind, die kovalent daran gebundene Peptidfragmente tragen. Diese Fragmente führen eine Vernetzung von Polysaccharidketten unter Bildung einer mechanisch starken Netzwerkstruktur durch. Beispielsweise ist die Zellwand von E. coli aus Polysaccharidketten aufgebaut, die aus N-Acetylglucosaminresten bestehen, die durch b-(1®4)-Bindungen verbunden sind, wobei jeder zweite Rest ein Fragment trägt, das am C3-Atom daran gebunden ist, gebildet durch Milchsäure durch Amidbindungen verbundene Säurereste, L-Alanin, D-Glutamat (über g-Carboxyl), Mesodiaminonimelinat und D-Alanin.
Glykoproteine sind am Transport verschiedener Substanzen beteiligt, an den Prozessen der Blutgerinnung, der Immunität, sind Bestandteile von Schleim und Sekreten des Magen-Darm-Trakts. Bei arktischen Fischen spielen Glykoproteine die Rolle von Frostschutzmitteln – Substanzen, die die Bildung von Eiskristallen in ihrem Körper verhindern.
Phosphoproteine. Sie haben Phosphorsäure als Nicht-Eiweiß-Komponente. Vertreter dieser Proteine sind Milchcaseinogen, Vitellin (Eigelbprotein), Ichthulin (Fischrogenprotein). Diese Lokalisierung von Phosphoproteinen weist auf ihre Bedeutung für den sich entwickelnden Organismus hin. In erwachsenen Formen sind diese Proteine in Knochen- und Nervengewebe vorhanden.
Lipoproteine. Komplexe Proteine, deren prosthetische Gruppe von Lipiden gebildet wird. Von der Struktur her sind dies kleine (150-200 nm) kugelförmige Partikel, deren äußere Hülle von Proteinen (die es ihnen ermöglichen, sich durch das Blut zu bewegen) und der innere Teil von Lipiden und ihren Derivaten gebildet wird. Die Hauptfunktion von Lipoproteinen ist der Transport von Lipiden durch das Blut. Abhängig von der Protein- und Lipidmenge werden Lipoproteine in Chylomikronen, Lipoproteine niedriger Dichte (LDL) und Lipoproteine hoher Dichte (HDL) unterteilt, die manchmal als a- und b-Lipoproteine bezeichnet werden.
Chylomikronen sind die größten Lipoproteine und enthalten bis zu 98-99 % Lipide und nur 1-2 % Protein. Sie werden in der Darmschleimhaut gebildet und sorgen für den Transport von Lipiden aus dem Darm in die Lymphe und weiter ins Blut.
1.1.3. Proteineigenschaften
Proteine haben ein hohes Molekulargewicht, einige sind wasserlöslich, quellfähig, zeichnen sich durch optische Aktivität, Mobilität in einem elektrischen Feld und einige andere Eigenschaften aus.
Proteine sind aktiv chemische Reaktionen eingehen. Diese Eigenschaft beruht darauf, dass die Aminosäuren, aus denen Proteine bestehen, verschiedene funktionelle Gruppen enthalten, die mit anderen Substanzen reagieren können. Es ist wichtig, dass solche Wechselwirkungen auch innerhalb des Proteinmoleküls stattfinden, was zur Bildung von Peptid-, Schwefelwasserstoff- und anderen Arten von Bindungen führt. An die Reste von Aminosäuren und damit von Proteinen können verschiedene Verbindungen und Ionen binden, die deren Transport durch das Blut gewährleisten.
Proteine sind Makromolekulare Verbindungen. Dies sind Polymere, die aus Hunderten und Tausenden von Aminosäureresten - Monomeren - bestehen. Dementsprechend liegt das Molekulargewicht von Proteinen im Bereich von 10 000 - 1 000 000. Ribonuklease (ein Enzym, das RNA abbaut) enthält also 124 Aminosäurereste und sein Molekulargewicht beträgt ungefähr 14 000. Myoglobin (Muskelprotein), bestehend aus 153 Aminosäureresten Säurereste, hat ein Molekulargewicht von 17.000 und Hämoglobin - 64.500 (574 Aminosäurereste). Die Molekulargewichte anderer Proteine sind höher: g-Globulin (bildet Antikörper) besteht aus 1250 Aminosäuren und hat ein Molekulargewicht von etwa 150.000, während das Molekulargewicht des Glutamat-Dehydrogenase-Enzyms 1.000.000 übersteigt.
Die wichtigste Eigenschaft von Proteinen ist ihre Fähigkeit, sowohl saure als auch basische Eigenschaften aufzuweisen, d. h. zu wirken Amphotere Elektrolyte. Dafür sorgen verschiedene dissoziierende Gruppen, aus denen die Aminosäurereste bestehen. Beispielsweise werden einem Protein durch Carboxylgruppen der Asparagin-Glutaminsäure saure Eigenschaften verliehen, während Arginin-, Lysin- und Histidinreste alkalische Eigenschaften verleihen. Je mehr Dicarbonsäuren ein Protein enthält, desto stärker sind seine sauren Eigenschaften und umgekehrt.
Dieselben Gruppierungen haben auch elektrische Ladungen, die sich bilden Gesamtladung eines Eiweißmoleküls. In Proteinen, in denen Asparagin- und Glutamin-Aminosäuren vorherrschen, ist die Ladung des Proteins negativ; ein Überschuss an basischen Aminosäuren verleiht dem Proteinmolekül eine positive Ladung. Infolgedessen bewegen sich Proteine in einem elektrischen Feld in Abhängigkeit von der Größe ihrer Gesamtladung zur Kathode oder Anode. So gibt das Protein in alkalischem Milieu (pH 7 - 14) ein Proton ab und wird negativ geladen, während in saurem Milieu (pH 1 - 7) die Dissoziation von Säuregruppen unterdrückt wird und das Protein zu einem Kation wird.
Entscheidend für das Verhalten eines Proteins als Kation oder Anion ist also die Reaktion des Mediums, die durch die Konzentration an Wasserstoffionen bestimmt und durch den pH-Wert ausgedrückt wird. Bei bestimmten pH-Werten gleicht sich jedoch die Anzahl positiver und negativer Ladungen an und das Molekül wird elektrisch neutral, d.h. es bewegt sich nicht in einem elektrischen Feld. Dieser pH-Wert des Mediums wird als isoelektrischer Punkt von Proteinen bezeichnet. In diesem Fall befindet sich das Protein im instabilsten Zustand und fällt bei leichten Änderungen des pH-Werts zur sauren oder alkalischen Seite leicht aus. Bei den meisten natürlichen Proteinen liegt der isoelektrische Punkt in einer leicht sauren Umgebung (pH 4,8 - 5,4), was auf das Vorherrschen von Dicarbonsäureaminosäuren in ihrer Zusammensetzung hinweist.
Die Fähigkeit von Proteinen ist wichtig adsorbieren auf seiner Oberfläche einige Stoffe und Ionen (Hormone, Vitamine, Eisen, Kupfer), die entweder schlecht wasserlöslich oder giftig sind (Bilirubin, freie Fettsäuren). Proteine transportieren sie durch das Blut zu Orten weiterer Umwandlungen oder Neutralisierungen.
Wässrige Lösungen von Proteinen haben ihre eigenen Eigenschaften. Erstens haben Proteine eine hohe Affinität zu Wasser, d.h. sie hydrophil. Das bedeutet, dass Proteinmoleküle wie geladene Teilchen Wasserdipole anziehen, die sich um das Proteinmolekül herum befinden und eine Wasser- oder Hydrathülle bilden. Diese Hülle schützt die Proteinmoleküle vor dem Zusammenkleben und Ausfällen. Die Größe der Hydrathülle hängt von der Struktur des Proteins ab. Beispielsweise binden Albumine leichter an Wassermoleküle und haben eine relativ große Wasserhülle, während Globuline und Fibrinogen Wasser schlechter binden und eine kleinere Hydratationshülle haben. Somit wird die Stabilität einer wässrigen Lösung eines Proteins durch zwei Faktoren bestimmt: das Vorhandensein einer Ladung auf dem Proteinmolekül und der es umgebenden Wasserhülle. Wenn diese Faktoren entfernt werden, fällt das Protein aus. Dieser Prozess kann reversibel und irreversibel sein.
Die Größe von Proteinmolekülen liegt im Bereich von 1 µm bis 1 nm und ist es daher Kolloidale Teilchen die in Wasser kolloidale Lösungen bilden. Diese Lösungen sind durch eine hohe Viskosität, die Fähigkeit sichtbare Lichtstrahlen zu streuen und nicht durch halbdurchlässige Membranen hindurchzugehen, gekennzeichnet.
1.2. Die Wirkung von Proteinen auf den menschlichen Körper
Die Funktionen von Proteinen im Körper sind vielfältig. Sie sind größtenteils auf die Komplexität und Vielfalt der Formen und Zusammensetzung der Proteine selbst zurückzuführen. Protein ist in vielen Lebensmitteln enthalten, aber die Hauptquellen sind Eier, Milch und Fleisch (Tabelle 1).
Tabelle 1 – Proteinhaltige Produkte
Proteine sind ein unverzichtbarer Baustoff. Eine der wichtigsten Funktionen von Proteinmolekülen ist Plastik. Alle Zellmembranen enthalten Proteine, deren Rolle hier vielfältig ist. Die Proteinmenge in den Membranen beträgt mehr als die Hälfte der Masse.
Viele Proteine haben kontraktile Funktion. Das sind zunächst die Proteine Aktin und Myosin, die Bestandteil der Muskelfasern höherer Organismen sind. Muskelfasern - Myofibrillen - sind lange dünne Filamente, die aus parallelen dünneren Muskelfilamenten bestehen, die von intrazellulärer Flüssigkeit umgeben sind. Es enthält gelöste Adenosintriphosphorsäure (ATP), die für die Durchführung der Kontraktion notwendig ist, Glykogen - ein Nährstoff, anorganische Salze und viele andere Substanzen, insbesondere Kalzium.
Die Rolle von Proteinen in Transport von Stoffen im Körper. Mit unterschiedlichen funktionellen Gruppen und einer komplexen Struktur des Makromoleküls binden und transportieren Proteine viele Verbindungen mit dem Blutstrom. Das ist vor allem Hämoglobin, das den Sauerstoff von der Lunge zu den Zellen transportiert. In Muskeln übernimmt ein anderes Transportprotein, Myoglobin, diese Funktion.
Eine weitere Funktion des Proteins ist Ersatzteil. Zu den Speicherproteinen gehören Ferritin – Eisen, Ovalbumin – Eiprotein, Casein – Milchprotein, Zein – Maissamenprotein.
Regulatorische Funktion Hormonproteine ausführen. Hormone sind biologisch aktive Substanzen, die den Stoffwechsel beeinflussen. Viele Hormone sind Proteine, Polypeptide oder einzelne Aminosäuren. Eines der bekanntesten Eiweißhormone ist Insulin. Dieses einfache Protein besteht nur aus Aminosäuren. Die funktionelle Rolle von Insulin ist vielfältig. Es senkt den Blutzucker, fördert die Synthese von Glykogen in Leber und Muskeln, erhöht die Bildung von Fetten aus Kohlenhydraten, beeinflusst den Phosphorstoffwechsel, reichert Zellen mit Kalium an.
Die Proteinhormone der Hypophyse, einer endokrinen Drüse, die mit einem der Teile des Gehirns verbunden ist, haben eine regulatorische Funktion. Es sondert Wachstumshormone ab, in deren Abwesenheit sich Zwergwuchs entwickelt. Dieses Hormon ist ein Protein mit einem Molekulargewicht von 27.000 bis 46.000.
Vasopressin ist eines der wichtigen und chemisch interessanten Hormone. Es hemmt das Wasserlassen und erhöht den Blutdruck. Vasopressin ist ein zyklisches Octapeptid.
Die regulatorische Funktion übernehmen auch die in der Schilddrüse enthaltenen Proteine - Thyreoglobuline mit einem Molekulargewicht von etwa 600 000. Diese Proteine enthalten Jod in ihrer Zusammensetzung. Mit der Unterentwicklung der Drüse ist der Stoffwechsel gestört.
Eine weitere Funktion von Proteinen ist schützend. Auf seiner Grundlage wurde ein Wissenschaftszweig namens Immunologie geschaffen.
Kürzlich Proteine mit Rezeptorfunktion. Es gibt Rezeptoren für Geräusche, Geschmack, Licht usw.
Erwähnt werden sollte auch das Vorhandensein von Proteinsubstanzen, die die Wirkung von Enzymen hemmen. Solche Proteine haben hemmende Funktionen. Bei der Wechselwirkung mit diesen Proteinen bildet das Enzym einen Komplex und verliert seine Aktivität ganz oder teilweise. Viele Enzyminhibitorproteine wurden in reiner Form isoliert und gut untersucht. Ihre Molekulargewichte variieren stark; oft beziehen sie sich auf komplexe Proteine - Glykoproteine, deren zweite Komponente Kohlenhydrate sind.
Wenn Proteine nur nach ihren Funktionen klassifiziert werden, kann eine solche Systematisierung nicht als vollständig angesehen werden, da neue Studien viele Fakten liefern, die es ermöglichen, neue Gruppen von Proteinen mit neuen Funktionen zu unterscheiden. Darunter sind einzigartige Substanzen - Neuropeptide(zuständig für die wichtigsten Lebensprozesse: Schlaf, Gedächtnis, Schmerz, Angst, Unruhe).
1.3. Änderung des Proteingehalts während der Verarbeitung
Unter dem Einfluss der Verarbeitung verändern sich die in den Produkten enthaltenen Proteine, Fette, Kohlenhydrate, Vitamine, Mineralien und Geschmacksstoffe, was sich auf die Verdaulichkeit, den Nährwert, das Gewicht, den Geschmack, den Geruch, die Farbe der verwendeten Produkte auswirkt.
Eichhörnchen koagulieren(Kollaps) bei Temperaturen über 70 ° C verlieren ihre Quellfähigkeit, wodurch nach der Wärmebehandlung die Masse von Fleisch und Fisch abnimmt.
Lebensmittel wie Fleisch, Fisch, Eier können nicht übermäßig gedämpft werden, da dies ihre Verdaulichkeit aufgrund von Veränderungen der Proteinmoleküle verringert: Kollagen geht in Glutin über und macht das Gewebe weicher.
Proteindenaturierung - dies ist ein komplexer Prozess, bei dem unter dem Einfluss äußerer Faktoren (Temperatur, mechanische Einwirkung, Einwirkung von Säuren, Laugen, Ultraschall usw.) eine Veränderung der Sekundär-, Tertiär- und Quartärstruktur des Proteinmakromoleküls auftritt, d. native (natürliche) räumliche Struktur. Die Primärstruktur und damit die chemische Zusammensetzung des Proteins ändern sich nicht. Während des Kochens wird die Denaturierung von Proteinen am häufigsten durch Erhitzen verursacht. Dieser Vorgang läuft bei globulären und fibrillären Proteinen unterschiedlich ab. Bei kugelförmigen Proteinen erhöht sich beim Erhitzen die thermische Bewegung der Polypeptidketten innerhalb der Kugel, die Wasserstoffbrückenbindungen, die sie an einer bestimmten Position gehalten haben, brechen auf und die Polypeptidkette entfaltet sich und faltet sich dann auf eine neue Weise. In diesem Fall wandern die polaren (geladenen) hydrophilen Gruppen, die sich auf der Oberfläche des Kügelchens befinden und dessen Ladung und Stabilität bereitstellen, ins Innere des Kügelchens, und es entstehen reaktive hydrophobe Gruppen (Disulfid, Sulfhydryl usw.), die kein Wasser zurückhalten können seine Oberfläche. Die Denaturierung geht mit Veränderungen der wichtigsten Eigenschaften des Proteins einher: Verlust einzelner Eigenschaften (z. B. Farbänderung von Fleisch beim Erhitzen durch Denaturierung von Myoglobin); Verlust der biologischen Aktivität (z. B. Kartoffeln, Pilze, Äpfel und eine Reihe anderer Pflanzenprodukte enthalten Enzyme, die zu einer Verdunkelung führen; wenn sie denaturiert werden, verlieren Enzymproteine ihre Aktivität); erhöhter Angriff von Verdauungsenzymen (wärmebehandelte proteinhaltige Lebensmittel werden in der Regel vollständiger und leichter verdaut); Verlust der Hydratationsfähigkeit (Auflösung, Quellung); Verlust der Stabilität von Proteinkügelchen, der mit ihrer Aggregation (Faltung oder Koagulation des Proteins) einhergeht.
Anhäufung- dies ist die Wechselwirkung denaturierter Proteinmoleküle, die mit der Bildung größerer Partikel einhergeht. Äußerlich drückt sich dies je nach Konzentration und kolloidalem Zustand von Proteinen in Lösung unterschiedlich aus. So bildet das geronnene Protein in Lösungen mit niedriger Konzentration (bis zu 1%) Flocken (Schaum auf der Oberfläche der Brühen). In konzentrierteren Proteinlösungen (z. B. Eiweiß) bildet die Denaturierung ein kontinuierliches Gel, das das gesamte im kolloidalen System enthaltene Wasser zurückhält.
Proteine, die mehr oder weniger wässrige Gele sind (Muskelproteine von Fleisch, Geflügel, Fisch; Proteine von Getreide, Hülsenfrüchten, Mehl nach Hydratation usw.), werden während der Denaturierung verdichtet, während ihre Dehydratisierung mit der Abscheidung von Flüssigkeit in die Umgebung erfolgt . Das dem Erhitzen ausgesetzte Proteingel hat in der Regel ein geringeres Volumen, eine geringere Masse, eine größere mechanische Festigkeit und Elastizität im Vergleich zu dem ursprünglichen Gel aus nativen (natürlichen) Proteinen. Die Aggregationsgeschwindigkeit von Proteinsolen hängt vom pH-Wert des Mediums ab. Proteine sind in der Nähe des isoelektrischen Punktes weniger stabil.
Proteinabbau. Bei längerer Wärmebehandlung unterliegen Proteine tieferen Veränderungen, die mit der Zerstörung ihrer Makromoleküle verbunden sind. In der ersten Phase der Veränderung können funktionelle Gruppen von Proteinmolekülen unter Bildung flüchtiger Verbindungen wie Ammoniak, Schwefelwasserstoff, Phosphorwasserstoff, Kohlendioxid usw. abgespalten werden. Sie reichern sich im Produkt an und sind an der Geschmacksbildung beteiligt und Aroma des Endprodukts. Während der weiteren hydrothermalen Behandlung werden Proteine hydrolysiert, während die primäre (Peptid-) Bindung unter Bildung löslicher stickstoffhaltiger Substanzen ohne Proteincharakter (z. B. Übergang von Kollagen zu Glutin) aufgebrochen wird. Die Zerstörung von Proteinen kann eine gezielte kulinarische Behandlung sein, die zur Intensivierung des technologischen Prozesses beiträgt (Verwendung von Enzympräparaten, um Fleisch weicher zu machen, das Gluten des Teigs zu schwächen, Proteinhydrolysate zu erhalten usw.).
Schäumen. Proteine werden häufig als Treibmittel bei der Herstellung von Süßwaren (Biskuitteig, Protein-Schlagteig), Schlagsahne, Sauerrahm, Eiern usw. verwendet. Die Stabilität des Schaums hängt von der Art des Proteins, seiner Konzentration und Temperatur ab .
1.4. Änderung des Proteingehalts während der Lagerung
Während der gekühlten Lagerung und dem Einfrieren von reinen Proteinlösungen kommt es zu einer Aggregation von Proteinmolekülen. Diesem Vorgang geht üblicherweise eine Proteindenaturierung voraus. Die Daten zur Bestimmung von Molekulargewicht, Sedimentationskonstanten und Diffusionsgeschwindigkeit der beim Einfrieren und Kühllagern gebildeten Proteinpartikel weisen auf strukturelle Veränderungen dieses Proteins hin. Einigen Berichten zufolge ist bei der Kühlung von Fisch nicht nur eine Verringerung, sondern auch eine Erhöhung der Proteinlöslichkeit möglich. So erhöhte sich beim Baltischen Hering die Proteinlöslichkeit im Muskelgewebe von gefrorenem Fisch auch während der Totenstarre.
Während der Lagerung von Fleisch werden günstige Bedingungen für die sekundäre Wechselwirkung von Lipiden mit Proteinen geschaffen. Denn native Proteine werden bei der Lagerung schnell zerstört, die strukturelle Ordnung von Zellmembranen geht verloren und die räumliche Differenzierung der chemischen Bestandteile von Zellen wird gestört. In diesem Fall interagieren sowohl polare als auch neutrale Fette sowie die Produkte ihrer Zersetzung und Oxidation mit Proteinen.
Wechselwirkungen zwischen Lipiden und Proteinen treten in Lebensmitteln und bei gefrorener Lagerung auf. Die Ergebnisse der Untersuchung von Fleisch und Fisch zeigten, dass sich die Löslichkeit verschiedener Proteinfraktionen von Muskelgewebe, der Gehalt an Sulfhydryl- und Disulfidgruppen in Proteinen sowie die Aktivität einer Reihe von Enzymen wellenförmig änderte.
Die qualitative Zusammensetzung der Aminosäuren während der Lagerung des Produkts wird von vielen Faktoren bestimmt und hängt von der Aktivität verschiedener Enzyme im Muskelgewebe und individuellen Umwandlungen von Aminosäuren, von der Aminosäurezusammensetzung von abbaubaren Proteinen, ihrer Menge und ihrem Angriffsgrad ab Enzyme, Änderungen des pH-Wertes, der Temperatur und anderer zusammenhängender Faktoren.
2. Praktischer Teil
2.1. Merkmale quantitativer Methoden zur Bestimmung des Proteingehalts
Verfahren zur quantitativen Bestimmung der Proteinfraktion basieren auf der Bestimmung der Gesamtstickstoffmenge. Am gebräuchlichsten ist die Bestimmung nach Kjeldahl, mit der Stickstoff in Form von Ammoniak nur aus Aminen und ihren Derivaten isoliert werden kann, aber einige stickstoffhaltige Verbindungen unter diesen Bedingungen zusammen mit Ammoniak auch molekularen Stickstoff bilden, der führt zu unterschätzten Daten.
Kjeldahl-Methode.
Die Kjeldahl-Methode ist relativ einfach, gut reproduzierbar, standardisiert und weist mehrere Modifikationen auf.
Das Verfahren umfasst drei Hauptschritte: Aufschluss, Destillation und Titration.
Das Verfahren basiert auf der Oxidation organischer Substanzen zu CO2, H2O, NH3 beim Erhitzen mit starker Schwefelsäure. Ammoniak reagiert mit überschüssiger H2SO4-Konzentration und bildet damit Ammoniumsulfat.
R-CHNH2COOH + H2SO4 → CO2 + H2O + NH3;
2NH3 + H2SO4 → (NH4)2SO4.
Nach beendeter Verbrennung der Probe wird die überschüssige Säure mit Lauge neutralisiert und das in Form von Ammoniumsulfat gebundene Ammoniak durch einen Überschuss an Lauge verdrängt.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH.
Nach dem Verbrennen der Probe wird Stickstoff kolorimetrisch durch die optische Dichte von farbigen Lösungen bestimmt, die durch Wechselwirkung mit Nessler-Reagenz erhalten werden.
Mit Nesslers Reagenz (Doppelsalz aus Quecksilberjodid und Kaliumjodid, gelöst in Ätzkalium) können sich Ammoniak und Ammoniumsalze bilden. Mercurammoniumiodid ist eine gelbbraune Substanz.
NH4OH + 2(HgI2KI) + 3KOH = OHg2NH2I + 7KI + 3H2O.
Methode der formalen Titration.
Eine andere quantitative Methode zur Bestimmung des Proteingehalts ist die formale Titrationsmethode, die üblicherweise in Molkereien verwendet wird.
Das Verfahren kann nur für die Analyse von frischer Rohmilch mit einem Säuregehalt von nicht mehr als 22 ºT verwendet werden. Eingemachte Proben können mit dieser Methode nicht kontrolliert werden.
Das Verfahren besteht darin, die NH2-Gruppen der Produktproteine mit dem eingeführten Formalin unter Bildung von Methylderivaten von Proteinen zu blockieren, deren Carboxylgruppen mit Alkali neutralisiert werden können:
HOOC – R – NH2 + 2HCHO → HCHO – R – N(CH2OH)2;
HCHO – R – N(CH2OH)2 + NaOH → NaOH – R – N(CH2OH)2 + H2O.
Die zur Titration saurer Carboxylgruppen eingesetzte Alkalimenge wird auf den Massenanteil der Proteine umgerechnet.
Die Studie wird nach folgendem Schema durchgeführt:
In einem Kolben mit einem Fassungsvermögen von 100 cm³ werden 20 cm³ des Testprodukts, 10-12 Tropfen 1%ige Phenolphthaleinlösung abgemessen und mit 0,1 N Natronlauge titriert, bis eine der Farbe des Standards entsprechende Rosafärbung auftritt. Dann werden 4 ml neutralisiertes 40 %iges Formalin mit einem automatischen Messgerät zugegeben und erneut mit 0,1 N Natronlauge titriert, bis die Farbe des Standards erreicht ist. Die für die zweite Titration verwendete Alkalimenge (während der ersten Titration wird sie zum Neutralisieren von Substanzen verwendet, die die Azidität des Produkts verursachen) wird mit dem Faktor 0,959 multipliziert und der Massenanteil von Proteinen im Produkt wird in Prozent erhalten .
Anhand einer Tabelle kann die Menge Natronlauge in Prozent Eiweiß umgerechnet werden.
| Verbrauch an 0,1 N NaOH-Lösung, ml |
Massenanteil Protein, % |
Verbrauch an 0,1 N NaOH-Lösung, ml |
Massenanteil Protein, % |
Tabelle 2 - Abhängigkeit des Massenanteils von Proteinen vom Volumen der Alkalilösung, die für die Titration von Proben in Anwesenheit von Formalin verwendet wurde
2.2. Merkmale qualitativer Methoden zur Bestimmung des Proteingehalts
Proteinfällungsreaktionen
Proteine in Lösung und dementsprechend im Körper werden aufgrund von Stabilitätsfaktoren, zu denen die Ladung des Proteinmoleküls und die es umgebende Hydrathülle gehören, in ihrem ursprünglichen Zustand konserviert. Die Entfernung dieser Faktoren führt zum Kleben von Proteinmolekülen und deren Ausfällung. Die Proteinfällung kann je nach Reagenzien und Reaktionsbedingungen reversibel oder irreversibel sein. In der Laborpraxis werden Präzipitationsreaktionen verwendet, um die Albumin- und Globulinfraktionen von Proteinen zu isolieren, ihre Stabilität zu quantifizieren, Proteine in biologischen Flüssigkeiten nachzuweisen und sie freizusetzen, um eine proteinfreie Lösung zu erhalten.
reversibler Niederschlag.
Unter dem Einfluss von Präzipitationsfaktoren fallen Proteine aus, aber nach Beendigung der Einwirkung (Entfernung) dieser Faktoren werden die Proteine wieder löslich und erhalten ihre nativen Eigenschaften. Eine Art reversibler Proteinfällung ist das Aussalzen.
aussalzen. Die Albuminfraktion von Proteinen fällt mit einer gesättigten Ammoniumsulfatlösung und die Globulinfraktion mit einer halbgesättigten Lösung aus.
Die Essenz der Reaktion ist die Dehydratisierung von Proteinmolekülen.
Definitionsfortschritt. 30 Tropfen einer unverdünnten Probe werden in ein Reagenzglas gegeben und mit der gleichen Menge einer gesättigten Ammoniumsulfatlösung versetzt. Mischen Sie den Inhalt des Röhrchens. Man erhält eine halbgesättigte Ammoniumsulfatlösung, während die Globulinfraktion ausfällt und die Albuminfraktion in Lösung bleibt. Letzteres wird abfiltriert und dann mit Ammoniumsulfatpulver gemischt, bis die Auflösung des Salzes aufhört und sich ein Niederschlag bildet - Globuline.
Irreversible Präzipitation von Proteinen.
Irreversible Präzipitation von Proteinen ist mit tiefgreifenden Störungen in der Struktur von Proteinen (sekundär und tertiär) und dem Verlust ihrer nativen Eigenschaften verbunden. Solche Veränderungen in Proteinen können durch Kochen, Einwirkung konzentrierter Lösungen von Mineral- und organischen Säuren, Salzen von Schwermetallen verursacht werden.
Niederschlag beim Sieden. Proteine sind thermolabile Verbindungen und werden bei Erwärmung über 50-60 Grad C denaturiert. Die Essenz der thermischen Denaturierung ist die Zerstörung der Hydrathülle, das Aufbrechen der Bindungen, die das Proteinkügelchen stabilisieren, und der Einsatz des Proteinmoleküls. Die vollständigste und schnellste Ausfällung erfolgt am isoelektrischen Punkt (wenn die Ladung des Moleküls Null ist), da die Proteinpartikel in diesem Fall am wenigsten stabil sind. Proteine mit sauren Eigenschaften fallen in einer leicht sauren Umgebung aus und Proteine mit basischen Eigenschaften - in einer leicht alkalischen Umgebung. In stark sauren oder stark alkalischen Lösungen fällt das beim Erhitzen denaturierte Protein nicht aus, da seine Partikel umgeladen werden und im ersten Fall eine positive, im zweiten Fall eine negative Ladung tragen, was ihre Stabilität in Lösung erhöht.
Definitionsfortschritt. Geben Sie 10 Tropfen Probenlösung in 4 nummerierte Röhrchen. Dann wird das 1. Rohr zum Sieden erhitzt, dabei wird die Lösung trüb, aber da die denaturierten Proteinpartikel geladen sind, fallen sie nicht aus. Dies liegt daran, dass Eiweiß saure Eigenschaften hat (sein isoelektrischer Punkt beträgt 4,8) und in einer neutralen Umgebung negativ geladen ist; In das zweite Rohr wird 1 Tropfen 1%ige Essigsäurelösung gegeben und zum Sieden erhitzt. Das Protein fällt aus, weil. seine Lösung nähert sich dem isoelektrischen Punkt und das Protein verliert seine Ladung (einer der Faktoren der Proteinstabilität in Lösung); 1 Tropfen 10%ige Essigsäurelösung in das 3. Röhrchen geben und zum Sieden erhitzen. Ein Niederschlag wird nicht gebildet, da die Proteinpartikel in einem stark sauren Medium eine positive Ladung annehmen (einer der Faktoren der Proteinstabilität in Lösung bleibt erhalten); 1 Tropfen NaOH-Lösung wird in das 4. Rohr gegossen und zum Sieden erhitzt. Es bildet sich kein Niederschlag, da die negative Ladung des Proteins im alkalischen Milieu zunimmt.
Fällung mit konzentrierten Mineralsäuren. Konzentrierte Säuren (Schwefel-, Salz-, Salpetersäure usw.) bewirken eine Proteindenaturierung, indem Proteinstabilitätsfaktoren in Lösung (Ladung und Hydratationshülle) entfernt werden. Bei einem Überschuss an Salz- und Schwefelsäure löst sich jedoch der ausgefallene Niederschlag des denaturierten Proteins wieder auf. Anscheinend geschieht dies durch die Umladung von Proteinmolekülen und deren teilweise Hydrolyse. Bei Zugabe eines Überschusses an Salpetersäure löst sich der Niederschlag nicht auf. Aus diesem Grund wird Salpetersäure in klinischen Studien zum Nachweis geringer Proteinmengen im Urin eingesetzt.
Definitionsfortschritt. 5 Tropfen konzentrierte Schwefel-, Salz- und Salpetersäure werden in drei Reagenzgläser gegossen. Dann wird das Reagenzglas in einem Winkel von 45 Grad geneigt und das gleiche Probenvolumen vorsichtig entlang der Wand geschichtet. An der Grenze der beiden Schichten erscheint ein Proteinniederschlag in Form eines weißen Rings. Schütteln Sie die Reagenzgläser vorsichtig, beobachten Sie die Auflösung des Proteins in den Reagenzgläsern mit Schwefel- und Salzsäure, im Reagenzglas mit Salpetersäure findet keine Proteinauflösung statt.
Ausfällung durch organische Säuren. Trichloressigsäure fällt nur Proteine aus, und Sulfosalicylsäure fällt nicht nur Proteine, sondern auch hochmolekulare Peptide aus.
Definitionsfortschritt. Geben Sie 5 Tropfen der Probenlösung in zwei Reagenzgläser. Dem einen werden 2 Tropfen Sulfosalicylsäure und dem anderen 5 Tropfen Trichloressigsäure zugesetzt. Protein-Präzipitate in Reagenzgläsern.
Ausfällung von Eiweiß durch Salze von Schwermetallen. Bei der Wechselwirkung mit Salzen von Blei, Kupfer, Quecksilber, Silber und anderen Schwermetallen werden Proteine denaturiert und ausgefällt. Bei einem Überschuss einiger Salze wird jedoch eine Auflösung des anfänglich gebildeten Niederschlags beobachtet. Dies ist auf die Ansammlung von Metallionen auf der Oberfläche des denaturierten Proteins und das Auftreten einer positiven Ladung auf dem Proteinmolekül zurückzuführen.
Definitionsfortschritt. Geben Sie 5 Tropfen der Probe in drei Reagenzgläser. Fügen Sie im ersten 1 Tropfen Bleiacetat hinzu, im dritten - 1 Tropfen Silbernitrat. Niederschlag tritt in allen Reagenzgläsern auf. Dann werden 10 Tropfen Silbernitrat in das erste Reagenzglas gegeben - es kommt zu keiner Auflösung des Niederschlags.
Farbreaktionen für Proteine
Farbreaktionen werden verwendet, um die Proteinnatur von Substanzen festzustellen, Proteine zu identifizieren und ihre Aminosäurezusammensetzung in verschiedenen biologischen Flüssigkeiten zu bestimmen.
Biuret-Reaktion für eine Peptidbindung. Sie beruht auf der Fähigkeit von Peptidbindungen (-CO-NH-), mit Kupfersulfat in alkalischem Medium farbige Komplexverbindungen zu bilden, deren Farbintensität von der Länge der Polypeptidkette abhängt. Die Proteinlösung ergibt eine blauviolette Farbe.
Definitionsfortschritt. 5 Tropfen Probelösung, 3 Tropfen NaOH, 1 Tropfen Cu(OH)2 ins Reagenzglas geben, mischen. Der Inhalt des Röhrchens nimmt eine blauviolette Farbe an.
Ninhydrin-Reaktion. Die Essenz der Reaktion ist die Bildung einer blau-violett gefärbten Verbindung, die aus Ninhydrin und Aminosäure-Hydrolyseprodukten besteht. Diese Reaktion ist charakteristisch für Aminogruppen in der -Position, die in natürlichen Aminosäuren und Proteinen vorhanden sind.
Definitionsfortschritt. Geben Sie 5 Tropfen der Probenlösung in das Reagenzglas, dann 5 Tropfen Ninhydrin, erhitzen Sie die Mischung zum Kochen. Es entsteht eine rosa-violette Farbe, die mit der Zeit blau-violett wird.
Xantoprotein-Reaktion. Wenn der Proteinlösung konzentrierte Salpetersäure zugesetzt und erhitzt wird, erscheint eine gelbe Farbe, die in Gegenwart von Alkali orange wird. Die Essenz der Reaktion ist die Nitrierung des Benzolrings zyklischer Aminosäuren mit Salpetersäure, um Nitroverbindungen zu bilden, die ausfallen. Die Reaktion zeigt das Vorhandensein zyklischer Aminosäuren im Protein.
Definitionsfortschritt. Auf 5 Tropfen Probelösung 3 Tropfen Salpetersäure geben und (vorsichtig!) erhitzen. Es erscheint ein gelber Niederschlag. Nach dem Abkühlen 10 Tropfen NaOH (vorzugsweise zum Niederschlag) zugeben, es erscheint eine orange Farbe.
Adamkevichs Reaktion. Die Aminosäure Tryptophan bildet im sauren Milieu in Wechselwirkung mit sauren Aldehyden rotviolette Kondensationsprodukte.
Definitionsfortschritt. 10 Tropfen Essigsäure werden zu einem Tropfen der Probe gegeben. Kippen Sie das Rohr und fügen Sie vorsichtig 0,5 ml Schwefelsäure tropfenweise entlang der Wand hinzu, damit sich die Flüssigkeiten nicht vermischen. Bei stehendem Reagenzglas erscheint an der Grenze der Flüssigkeiten ein rotvioletter Ring.
Fohl-Reaktion. Aminosäuren, die Sulfhydrylgruppen enthalten - SH, werden einer alkalischen Hydrolyse unter Bildung von Natriumsulfid Na2S unterzogen. Letzteres bildet in Wechselwirkung mit Natriumplumbit (gebildet während der Reaktion zwischen Bleiacetat und NaOH) einen schwarzen oder braunen Niederschlag von Bleisulfid PbS.
Definitionsfortschritt. 5 Tropfen Fohl's Reagenz werden zu 5 Tropfen der Probenlösung gegeben (ein gleiches Volumen einer 30%igen NaOH-Lösung wird zu einer 5%igen Bleiacetatlösung gegeben, bis sich der gebildete Niederschlag auflöst). und 2-3 Minuten kochen. Nach dem Absetzen 1-2 min. es erscheint ein schwarzer oder brauner Niederschlag.
3. Experimenteller Teil
3.1. Begründung für die Wahl des Studiengegenstandes
Ich habe ein Hühnerei als Gegenstand meiner Forschung gewählt, da es die Hauptquelle für Protein und viele für den menschlichen Körper notwendige Substanzen ist und das Ei in der Ernährung eines jeden Menschen enthalten ist.
Jedes Jahr werden weltweit etwa eine Milliarde, also Tausende Milliarden Eier verzehrt. Jeder Mensch isst durchschnittlich 200 Eier pro Jahr. Aber Eier sind nicht nur ein gewöhnliches Lebensmittel.
Eier sind nicht nur ein reichhaltiger Nährstoffcocktail, dank Eiern sind Ihrer kulinarischen Fantasie keine Grenzen gesetzt. Deutsche lieben weich gekochte Eier zum Frühstück, Amerikaner nennen ihre Eier „Sunny Side Up“, Spanier lieben ihre Tortilla, Italiener bevorzugen Fritata, eine Art Omelett, und Gourmet-Japaner dippen rohes Fleisch in frisch gelegte Eier.
Wohl kein anderes Produkt wird so häufig in der Küche verwendet wie ein frisches Ei. In Torten, Desserts, Eiscreme, Gourmet-Saucen oder jedermanns Lieblings-Eiernudeln – überall geben Eier ihre goldene Dotterfarbe ab.
Höchste Eiweißqualität und die Kombination verschiedener Vitalstoffe machen Eier zu einem äußerst wertvollen Lebensmittel. Ein großes Ei enthält etwa neun Gramm Eiweiß, acht Gramm Fett, den Wertstoff Lecithin sowie weitere Mineralstoffe und Vitamine – mit Ausnahme von Vitamin C. Vitamine verstecken sich vor allem im Eigelb.
Das wichtigste Vitamin ist Vitamin A und seine Provitamine - Carotinoide. Das sogenannte „Augenvitamin“ verbessert die Sehkraft. Es wird in der Netzhaut des Auges sowohl für die Wahrnehmung von Licht und Dunkelheit als auch für die Farbunterscheidung benötigt. Vitamin A spielt auch eine wichtige Rolle im Immunsystem und fördert das Wachstum und die Stärkung von Haaren, Haut und Zähnen.
Hühnereier sind auch eine Quelle für Vitamin B, das für den reibungslosen Stoffwechsel, die Zellatmung und die Bildung von roten Blutkörperchen - Erythrozyten - verantwortlich ist.
Ein Ei deckt den Tagesbedarf an Folsäure zu 26 Prozent. Dieses besonders instabile Vitamin baut neue Zellen auf und aktiviert das Wachstum. Folsäuremangel ist eine der häufigsten Formen von Vitaminmangel und tritt oft zusammen mit Eisenmangel auf. Eier sind aber auch eine wahre Mineralstoffkammer: Kalzium, Magnesium, Kalium, Eisen, Zink, Jod und Fluor machen das Ei zu einem der nahrhaftesten Lebensmittel der Erde.
Eier sind eine gute Proteinquelle, daher werden sie in der folgenden Tabelle als Grundlage für den Vergleich mit anderen Lebensmitteln verwendet. Eiern wird ein bedingter Wert von 100 zugewiesen.
Die angegebenen Zahlen beziehen sich auf ganze Eier, nicht auf Eiweiß oder Eigelb. Heutzutage ist es in Mode, nur Proteine zu essen, da sie kein Fett enthalten. Tatsächlich enthält das Eigelb nicht weniger Protein. Und der Gehalt an Vitaminen und Mineralstoffen ist noch höher.
Anhand der Daten in der Tabelle können wir schlussfolgern, dass Eier die Hauptproteinquelle sind.
Im Vergleich zu anderen tierischen Produkten enthält ein Hühnerei das vollständigste Protein, das vom Körper fast vollständig aufgenommen wird. Eiprotein enthält alle essentiellen Aminosäuren im optimalsten Verhältnis.
Unten ist eine Tabelle, die das Proteingewicht in einigen Proteinquellen und den Prozentsatz dieses Proteins zeigt, der tatsächlich von unserem Körper aufgenommen werden kann.
Tabelle 4 – Gewichtsgehalt an Protein in Produkten, %
Die Tabelle zeigt, dass beispielsweise Eier nur 12 % Eiweiß enthalten, aber aufgrund einer bestimmten Zusammensetzung der Aminosäuren 94 % des Eiweißes vom Körper aufgenommen werden können. Andererseits macht Protein 42 % von Sojamehl aus, aber die Zusammensetzung dieses Proteins ermöglicht es Ihnen, nur 61 % dieser Menge aufzunehmen.
Basierend auf den Daten in der Tabelle können wir schließen, dass es einen großen Unterschied zwischen dem Gesamtproteingehalt von Lebensmitteln (was wir auf den Etiketten lesen) und der Menge gibt, die der Körper tatsächlich verwendet.
Wenn Sie sich die Liste in der Tabelle ansehen, können Sie sehen, dass Lebensmittel wie Reis, Bohnen und Kartoffeln viel weniger gesundes Protein enthalten als Eier. Der Grund dafür ist der zu geringe Gehalt an notwendigen Aminosäuren, die für die vollständige Aufnahme von Protein durch den Körper notwendig sind.
Dementsprechend werden Proteine, denen essentielle Aminosäuren fehlen, als unvollständig bezeichnet; diejenigen, in denen genügend essentielle Aminosäuren vorhanden sind, sind vollständig, Eiproteine sind vollständig.
Daraus können wir schließen, dass ein Hühnerei im Vergleich zu anderen tierischen Produkten das vollständigste Protein enthält, das vom Körper fast vollständig aufgenommen wird. Eiprotein enthält alle essentiellen Aminosäuren im optimalsten Verhältnis.
Nach aktuellen russischen Standards sollte jedes auf einer Geflügelfarm produzierte Ei gekennzeichnet sein.
Das erste Zeichen im Etikett gibt die zulässige Haltbarkeit an:
Der Buchstabe "D" - bezeichnet ein Diätei, solche Eier werden innerhalb von 7 Tagen verkauft.
Der Buchstabe "C" - bezeichnet ein Tafelei, das innerhalb von 25 Tagen verkauft wird.
Das zweite Zeichen in der Kennzeichnung bedeutet die Kategorie des Eies, abhängig von seinem Gewicht:
Ausgewähltes Ei (O) - von 65 bis 74,9 g.
Eigenschaften des Studiengegenstandes
Als Untersuchungsobjekt habe ich drei Proben ausgewählt – Hühnereier, die auf der Chelyabinsk Poultry Farm OJSC (CHEPFA) produziert wurden.
Chelyabinsk Poultry Farm OJSC ist eines der fünf größten Geflügelunternehmen in Russland. Die Haupttätigkeit ist die Produktion, Verarbeitung, Lagerung und der Verkauf von landwirtschaftlichen Produkten. Das Hauptprodukt des Geflügelhofes ist ein hochwertiges Hühnerei, das vom Lohmann LSL-Classic-Langlaufvogel gewonnen wird. Heute vereint die JSC Chelyabinsk Poultry Farm fünf strukturelle Unterabteilungen: Chelyabinsk Poultry Farm, Yemanzhelinsky Breeding Farm, Petropawlowsk Getreidekomplex, Yemanzhelinsky Getreideempfangszentrum und Kurochkino Sanatorium.
Probe Nr. 1 - Diätei der ersten Kategorie (D1), hergestellt am 26. März 2009, mit einer Masse von 62 Gramm.
Probe Nr. 2 - Tafelei der ersten Kategorie (C1), hergestellt am 26. März 2009, mit einer Masse von 59 Gramm.
Probe Nr. 3 ist ein Tafelei der Wahl (CO), hergestellt am 26. März 2009, mit einer Masse von 68 Gramm.
Verfahren zur Abschätzung des Proteingehalts
Im Rahmen der Arbeit wurde die Kjeldahl-Golub-Mikromethode als Methode zur Beurteilung des Proteingehalts im Produkt verwendet.
Die Studie wird nach folgendem Schema durchgeführt:
Eine abgewogene Portion des Testprodukts in einem Volumen von 0,04 g, entnommen mit einer Genauigkeit von ±0,0001, wird in ein Reagenzglas gegeben. Dann werden nacheinander 2 ml H2SO4 (spezifisches Gewicht 1,84) und 1...2 Tropfen H2O2 (33%) injiziert. Die Mineralisierung erfolgt durch Erhitzen des Reagenzglases in einem Wasserbad bei einer Temperatur von 85 Grad.
Dabei werden leicht oxidierbare Substanzen innerhalb von 1–2 Minuten vollständig oxidiert und die verfärbte Flüssigkeit bleibt beim weiteren Erhitzen farblos.
Am Ende der Oxidation wird der Reagenzglasinhalt quantitativ bis zur Marke in einen 100-ml-Messkolben überführt. Nach gutem Mischen des Kolbeninhalts eine Probe von 10 ml entnehmen und mit 0,5 N NaOH genau gegen Phenolphthalein titrieren, um die für die Neutralisation erforderliche Alkalimenge zu bestimmen.
Danach wird eine Probe derselben Lösung in 10 ml entnommen und in einen anderen 100-ml-Messkolben überführt, eine vorgeschriebene Menge 0,5 N NaOH wird hinzugefügt, um die Säure zu neutralisieren. Anschließend mit Wasser bis zur Marke auffüllen und gut schütteln. Diese Flüssigkeit wird verwendet, um farbige Lösungen herzustellen.
Herstellung von farbigen Lösungen. Dazu werden Arbeits- und Standardlösungen in zwei Messkolben mit einem Fassungsvermögen von 100 ml angesetzt. In einen werden 10 ml der Prüflösung gegossen, beide Kolben zu drei Viertel mit Wasser aufgefüllt, dann 4 ml Nessler-Lösung zugegeben und zur Marke gebracht.
Bestimmen Sie dann die optische Dichte der erhaltenen farbigen Lösungen.
Anhand der Analysedaten wird der Proteingehalt (%) nach folgender Formel berechnet:
wobei 0,002 die Stickstoffmenge in mg in 1 ml der Standardarbeitslösung ist;
Dm ist die optische Dichte der Arbeitslösung;
Dm ist die optische Dichte der Standardlösung;
m das Gewicht der eingewogenen Portion der Prüfsubstanz, g;
K - Umrechnungsfaktor von Stickstoff zu Protein, gleich 6,25 für Produkte tierischen Ursprungs; für Produkte pflanzlichen Ursprungs 5.7.
3.2. Analyse der Ergebnisse unserer eigenen Forschung

Abbildung 1 – Proteingehalt in den untersuchten Proben
Tabelle 5 – Die Menge an Proteingehalt in den untersuchten Proben
Das meiste Protein findet sich im Diätei der ersten Kategorie (D1) (Probe Nr. 1). Denn das Diät-Ei ist das frischeste Ei, das vor nicht mehr als einer Woche gelegt wurde. Studien zufolge laufen im Ei noch eine Woche lang mikrobiologische Prozesse ab, d.h. es lebt. Während einer Woche Lagerung hat die qualitative und quantitative Zusammensetzung von Protein und Aminosäuren in Eiern keine Zeit, sich wesentlich zu ändern. Aber in Übereinstimmung mit den Literaturdaten sollte das Eiweiß eines diätetischen Eiproteins etwa 19 % Protein und etwa 18 % im Eigelb enthalten, und die Studie ergab, dass der Proteingehalt im Protein und im Eigelb 18,7 % beträgt 17,6 % . Daraus lässt sich schließen, dass die Abweichungen im Eiweißgehalt zwar gering, aber dennoch vorhanden sind, bedingt durch unsachgemäße Lagerung des Eies.
Das ausgewählte Tafelei (CO) (Probe Nr. 3) enthält weniger Protein als ein Diätei, was durch die Haltbarkeit des Eies erklärt wird. Das Ei muss kühl, aber nicht zu trocken gelagert werden; die beste Temperatur ist 0 - +5 °C. Bei optimaler Luftfeuchtigkeit und Kohlendioxidgehalt können Eier bis zu 9 Monate gelagert werden. Aber gleichzeitig kommt es zu einer Denaturierung und Aggregation des Proteins im Ei. Gemäß den Literaturdaten sollte das Eiweiß eines Tafeleis etwa 17 % Protein und etwa 16 % im Eigelb enthalten, und die Studie ergab, dass der Proteingehalt im Protein 16,5 % und im Eigelb 15,7 % beträgt. . Daraus lässt sich schließen, dass die Abweichungen im Proteingehalt gering sind, aber dennoch bestehen, was sich damit erklärt, dass bei der Lagerung nicht alle notwendigen Bedingungen erfüllt sind.
Im Tafelei der ersten Kategorie (C1) (Orazets Nr. 2) unterscheidet sich der Proteingehalt nicht wesentlich vom Proteingehalt im Tafelei, was dadurch erklärt wird, dass sich das Tafelei der ersten Kategorie von unterscheidet das Tafelei nur im Gewicht. Im Protein der Probe Nr. 2 beträgt der Proteingehalt 16,5 % und im Eigelb 15,7 %, was den Literaturangaben entspricht, jedoch mit einigen Abweichungen.
Dabei stellte sich heraus, dass Proteine organische Substanzen tierischen oder pflanzlichen Ursprungs sind, die den Zellaufbau des menschlichen Körpers unterstützen. Ihr Hauptelement sind zahlreiche Aminosäuren.
Aminosäuren kommen in allen Produkten pflanzlichen und tierischen Ursprungs vor, aber ihr Gehalt und Verhältnis in Produkten ist unterschiedlich.
Untersuchungsgegenstand war das Hühnerei als Hauptproteinquelle. Aufgrund der Ergebnisse der Studie kann geschlussfolgert werden, dass die Qualität der Eier moderner Erzeuger und der darin enthaltene Proteingehalt den normalisierten Indikatoren entsprechen, jedoch mit geringfügigen Abweichungen, was durch die Dauer der Lagerung und die mögliche Inkonsistenz von erklärt wird das Eilagerungsschema.
Im Laufe der Arbeit wurde das Hauptziel erreicht: Die Hauptproteinquellen wurden identifiziert - dies sind Produkte tierischen Ursprungs - Milch, Fleisch, Fisch, Eier (enthalten essentielle Aminosäuren in den günstigsten Verhältnissen) und pflanzlichen Ursprungs, wie Erbsen, Bohnen, Buchweizen und Graupen, Hirse, Reis; und es wurde auch festgestellt, dass Proteine notwendige und lebenswichtige Elemente der chemischen Zusammensetzung von Lebensmitteln sind, die viele Funktionen erfüllen - plastisch, kontraktil, zurückhaltend, regulierend und schützend.
Proteine sind die Grundlage einer gesunden und richtigen Ernährung, daher ist es notwendig, die Ernährungskultur der Bevölkerung des Landes zu verbessern und einen gesunden Lebensstil zu fördern.
Referenzliste
1. Potoroko I.Yu., Kalinina I.V. Theoretische Grundlagen der Warenkunde und Untersuchung von Konsumgütern: Laborworkshop. - Tscheljabinsk: Verlag der SUSU, 2005. - 97 p.
2. Vermarktung von Fleisch- und Eiprodukten. Rohstoffkunde von Milchprodukten und Lebensmittelkonzentraten: Proc./G. N. Kruglyakov, G. V. Kruglyakova.-M.: Marketing, 2001.
3. Chemische Zusammensetzung russischer Lebensmittel / Ed. I. M. Skurikhin, V. A. Tutelyan; Ros. akad. Honig. Wissenschaften, Institut für Ernährung.-M.: DeLi print, 2002.
4. http://ru.wikipedia.org/wiki/Proteine
5. http://www.chepfa.ru
Anhang 1
Berechnungstagebuch
Probe Nr. 1. Diät-Ei der ersten Kategorie
Protein: optische Dichte der Testprobe – 0,237
Probengewicht - 0,0465 g
X \u003d (0,002 x 0,237 x 100 x 6,25) / (0,35 x 0,0465) \u003d 18,1 %
Eigelb: optische Dichte der Testprobe - 0,220
optische Dichte der Standardlösung - 0,35
Probengewicht - 0,0457 g
X \u003d (0,002 x 0,220 x 100 x 6,25) / (0,35 x 0,0457) \u003d 17,3 %
Probe Nr. 2. Tafelei der ersten Kategorie
Protein: optische Dichte der Testprobe – 0,186
optische Dichte der Standardlösung - 0,35
Probengewicht - 0,0401 g
X \u003d (0,002 x 0,186 x 100 x 6,25) / (0,35 x 0,0401) \u003d 16,5 %
Eigelb
optische Dichte der Standardlösung - 0,35
Probengewicht - 0,0406 g
X \u003d (0,002 x 0,179 x 100 x 6,25) / (0,35 x 0,0406) \u003d 15,7 %
Probe Nr. 3. Ausgewähltes Tafelei
Protein: optische Dichte der Testprobe – 0,179
optische Dichte der Standardlösung - 0,35
Probengewicht - 0,0443 g
X \u003d (0,002 x 0,179 x 100 x 6,25) / (0,35 x 0,0443) \u003d 16,1 %
Eigelb: optische Dichte der Testprobe – 0,176
optische Dichte der Standardlösung - 0,35
Probengewicht - 0,0409 g
X \u003d (0,002 x 0,176 x 100 x 6,25) / (0,35 x 0,0409) \u003d 15,3 %