Aus welchen elementen besteht ein protein. Proteinzusammensetzung: Was wissen wir darüber? Peptidtheorie von E. Fisher
Die grundlegenden Eigenschaften von Proteinen hängen von ihrer chemischen Struktur ab. Proteine sind hochmolekulare Verbindungen, deren Moleküle aus Alpha-Aminosäureresten aufgebaut sind, d.h. Aminosäuren, bei denen die primäre Aminogruppe und die Carboxylgruppe an dasselbe Kohlenstoffatom gebunden sind (das erste Kohlenstoffatom von der Carbonylgruppe gezählt).
19-32 Arten von Alpha-Aminosäuren werden durch Hydrolyse aus Proteinen isoliert, aber normalerweise werden 20 Alpha-Aminosäuren erhalten (dies sind die sog proteinogen Aminosäuren). Ihre allgemeine Formel lautet:
gemeinsamer Teil für alle Aminosäuren
R ist ein Radikal, d.h. eine Gruppierung von Atomen in einem Aminosäuremolekül, die mit einem Alpha-Kohlenstoffatom assoziiert ist und nicht an der Bildung des Rückgrats der Polypeptidkette beteiligt ist.
Unter den Hydrolyseprodukten vieler Proteine wurden Prolin und Hydroxyprolin gefunden, die die Iminogruppe =NH und nicht die Aminogruppe H 2 N- enthalten und eigentlich Iminosäuren und keine Aminosäuren sind.
Aminosäuren sind farblose kristalline Substanzen, die bei hohen Temperaturen (über 250°C) unter Zersetzung schmelzen. Zum größten Teil leicht löslich in Wasser und unlöslich in Ether und anderen organischen Lösungsmitteln.
Aminosäuren enthalten gleichzeitig zwei ionisationsfähige Gruppen: eine Carboxylgruppe, die saure Eigenschaften hat, und eine Aminogruppe, die basische Eigenschaften hat, d.h. Aminosäuren sind amphotere Elektrolyte.
Aminosäuren liegen in stark sauren Lösungen als positiv geladene Ionen und in alkalischen Lösungen als negative Ionen vor.
Je nach pH-Wert des Mediums kann jede Aminosäure entweder positiv oder negativ geladen sein.
Als isoelektrischer Punkt wird der pH-Wert des Mediums bezeichnet, bei dem die Aminosäurepartikel elektrisch neutral sind.
Alle von Proteinen abgeleiteten Aminosäuren mit Ausnahme von Glycin sind optisch aktiv, da sie ein asymmetrisches Kohlenstoffatom in alpha-Position enthalten.
Von den 17 optisch aktiven Protein-Aminosäuren sind 7 durch eine Rechts-/+/- und 10 eine Links-/-/-Rotation der Ebene des polarisierten Strahls gekennzeichnet, aber sie gehören alle zur L-Reihe.
Aminosäuren der D-Serie wurden in einigen natürlichen Verbindungen und biologischen Objekten gefunden (z. B. in Bakterien und in den Antibiotika Gramicidin und Actinomycin). Die physiologische Bedeutung von D- und L-Aminosäuren ist unterschiedlich. Aminosäuren der D-Reihe werden von Tieren und Pflanzen in der Regel entweder gar nicht oder nur schlecht resorbiert, da die Enzymsysteme von Tieren und Pflanzen spezifisch an L-Aminosäuren angepasst sind. Es ist bemerkenswert, dass optische Isomere durch den Geschmack unterschieden werden können: Aminosäuren der L-Reihe sind bitter oder geschmacklos, und Aminosäuren der D-Reihe sind süß.
Alle Gruppen von Aminosäuren sind durch Reaktionen gekennzeichnet, an denen Aminogruppen oder Carboxylgruppen oder beide gleichzeitig teilnehmen. Darüber hinaus sind Aminosäurereste zu vielfältigen Wechselwirkungen befähigt. Aminosäurereste reagieren:
Salzbildung;
Redoxreaktionen;
Acylierungsreaktionen;
Veresterung;
Amidierung;
Phosphorylierung.
Diese Reaktionen, die zur Bildung farbiger Produkte führen, werden häufig zur Identifizierung und halbquantitativen Bestimmung einzelner Aminosäuren und Proteine verwendet, z. B. Xantoprotein-Reaktion (Amidierung), Millon (Salzbildung), Biuret (Salzbildung) , Ninhydrin-Reaktion (Oxidation) usw.
Auch die physikalischen Eigenschaften von Aminosäureresten sind sehr vielfältig. Dies betrifft vor allem ihre Lautstärke, Ladung. Die Vielfalt der Aminosäurereste in Bezug auf chemische Natur und physikalische Eigenschaften bestimmt die polyfunktionellen und spezifischen Eigenschaften der Proteine, die sie bilden.
Die Klassifizierung von in Proteinen vorkommenden Aminosäuren kann nach verschiedenen Kriterien erfolgen: nach der Struktur des Kohlenstoffgerüsts, nach dem Gehalt an -COOH- und H 2 N-Gruppen usw. Die sinnvollste Klassifizierung basiert auf Unterschieden in der Polarität von Aminosäureresten bei pH 7, d.h. bei einem den intrazellulären Bedingungen entsprechenden pH-Wert. Dementsprechend lassen sich die Aminosäuren, aus denen Proteine bestehen, in vier Klassen einteilen:
Aminosäuren mit unpolaren Resten;
Aminosäuren mit ungeladenen polaren Resten;
Aminosäuren mit negativ geladenen polaren Resten;
Aminosäuren mit positiv geladenen polaren Resten
Betrachten Sie die Struktur dieser Aminosäuren.
Aminosäuren mit unpolaren R-Gruppen (Radikale)
Diese Klasse umfasst vier aliphatische Aminosäuren (Alanin, Valin, Isoleucin, Leucin), zwei aromatische Aminosäuren (Phenylalanin, Tryptophan), eine schwefelhaltige Aminosäure (Methionin) und eine Iminosäure (Prolin). Eine gemeinsame Eigenschaft dieser Aminosäuren ist ihre geringere Wasserlöslichkeit im Vergleich zu polaren Aminosäuren. Ihre Struktur ist wie folgt:
Alanin (α-Aminopropionsäure)
Valin (α-Aminoisovaleriansäure)
Leucin (α-Aminoisocapronsäure)
Isoleucin (α-Amino-β-methylvaleriansäure)
Phenylalanin (α-Amino-β-phenylpropionsäure)
Tryptophan (α-Amino-β-indolpropionsäure)
Methionin (α-Amino-γ-methyl-thiobuttersäure)
Prolin (Pyrrolidin-α-Carbonsäure)
2. Aminosäuren mit ungeladenen polaren R‑Gruppen (Radikale)
Diese Klasse umfasst eine aliphatische Aminosäure, Glycin (Glykokol), zwei Hydroxyaminosäuren, Serin und Threonin, eine schwefelhaltige Aminosäure, Cystein, eine aromatische Aminosäure, Tyrosin, und zwei Amide, Asparagin und Glutamin.
Diese Aminosäuren sind wasserlöslicher als Aminosäuren mit unpolaren R-Gruppen, da ihre polaren Gruppen Wasserstoffbrückenbindungen mit Wassermolekülen bilden können. Ihre Struktur ist wie folgt:
Glycin oder Glycocol (α-Aminoessigsäure)
Serin (α-Amino-β-hydroxypropionsäure)
Threonin (α-Amino-β-hydroxybuttersäure)
Cystein (α-Amino-β-thiopropionsäure)
Tyrosin (α-Amino-β-parahydroxyphenylpropionsäure)
Asparagin
Essentielle Aminosäuren werden produktiv genutzt. Die biologische und chemische Zusammensetzung von Proteinen hängt direkt von ihrer Aminosäurezusammensetzung ab.
Die chemische Zusammensetzung von Proteinen
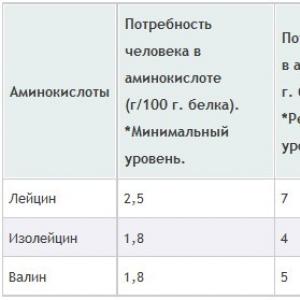
Dem Eiweiß des Säugetierorganismus fehlt Lysin (ein Lysinmangel von etwa 6 %). Die Zugabe dieser Aminosäure beschleunigt das Wachstum von Tieren.
Kuhmilchproteine enthalten einen Überschuss an Lysin, Leucin, Tryptophan, Histidin und Threonin und gleich 20%.
Maisproteine sind viel schlechter als die ersten beiden Gruppen von Nahrungsproteinen. Sie haben einen Mangel an vielen Aminosäuren: Lysin (60 % der Norm), Tryptophan, schwefelhaltige Aminosäuren, Valin, Isoleucin und Threonin. Diese Proteine enthalten einen Überschuss an Leucin, Histidin, Phenylanin (Tyrosin). Die biologische Wertigkeit pflanzlicher Proteine lässt sich durch die Kombination mit Milchproteinen deutlich steigern. Somit ist eine Mischung aus 60 % Maisproteinen und 40 % Milchproteinen in ihrer biologischen Wertigkeit fast gleichwertig mit Milchproteinen. Die Kombination aus pflanzlichen und tierischen Proteinen sorgt für die beste Regeneration der Hämoglobinbestandteile.
Aminosäurezusammensetzung von Proteinen
In einer vergleichenden Untersuchung der Aminosäurezusammensetzung von Proteinen und ihren äquivalenten Aminosäuremischungen wurden die besten Ergebnisse mit Proteinen erzielt.
In Tierversuchen wurde gezeigt, dass massive Dosen jeder Aminosäure eine toxische Wirkung hervorrufen können. Die untersuchten Aminosäuren der Proteinzusammensetzung wurden Diäten zugesetzt, die unterschiedliche Proteinmengen enthielten. Die Zugabe von 6-12 % Methionin zum Futter führte zu hoher Sterblichkeit, verminderter Futteraufnahme, Gewichtsverlust, Atrophie von Leber und Milz.Die toxische Wirkung von Methionin verstärkte sich bei Diäten mit unzureichendem Vitamin B8. Der Zusatz von Glycin verringerte die toxische Wirkung von Methionin. Gleichzeitig hat eine Proteinerhöhung in der Nahrung seit jeher eine protektive Wirkung.
Als Indikator für den Nährwert der Zusammensetzung von Proteinen wird der Proteineffizienzkoeffizient (PBE) verwendet. In der Praxis ist es üblich, den CBE bei einem bestimmten Proteingehalt in der Nahrung zu bestimmen, meistens bei 10 %.
Einige Forscher glauben, dass der maximale Wert der biologischen Wertigkeit auf einer Proteinebene in der Ernährung erreicht wird, die den endogenen Bedarf des Menschen deckt, d.h. 15 bis 33 g Protein pro Tag. Es wird vorgeschlagen, die in diesem Fall erhaltenen Werte des biologischen Werts als absolut (ABC) zu bezeichnen.
Es wurde auch ein Verfahren zur Bestimmung des Nährwerts von Proteinen durch die Assimilation einzelner Aminosäuren und deren Gleichgewicht vorgeschlagen. Essentielle Aminosäuren werden in der Regel zu verschiedenen Zeitpunkten nach einer Mahlzeit im Blut bestimmt.
Proteineigenschaften
„Leben – das ist die Daseinsform von Eiweißkörpern“ (F. Engels). Die Bestandteile des menschlichen Körpers implementieren die Eigenschaften von Proteinen (Muskeln, Herz, Gehirn und sogar Knochen enthalten eine erhebliche Menge an Proteinen), aber auch die Beteiligung von Proteinmolekülen an allen wichtigen Prozessen des menschlichen Lebens. Alle Enzyme basieren auf den chemischen Eigenschaften von Proteinen, viele Hormone sind ebenfalls Proteine; Antikörper, die Immunität verleihen, sind Proteine.
Der Wert der Eigenschaften von Proteinen wird nicht nur durch die Vielfalt ihrer Funktionen bestimmt, sondern auch durch ihre Unverzichtbarkeit gegenüber anderen Nährstoffen. Deshalb alles Proteineigenschaften gelten als die wertvollsten Bestandteile von Lebensmitteln. Die Erfahrung hat gezeigt, dass eine längere eiweißfreie Ernährung zum Tod des Körpers führt.
Chemische Eigenschaften von Proteinen
Lebensmittelproteine sind sehr komplexe makromolekulare Verbindungen, und diese chemischen Eigenschaften von Proteinen setzen sich aus verschiedenen Aminosäuren zusammen, deren Zahl bis zu 80 beträgt. Die meisten Lebensmittel enthalten jedoch etwa 20 Aminosäuren. Die Vielfalt von Proteinen wird in der Aminosäurekette (der Primärstruktur der Proteineigenschaft), zusätzlichen Aminosäurebindungen innerhalb der Polypeptidkette (Sekundärstruktur) und den Merkmalen der räumlichen Anordnung von Polypeptid-Chemieketten (Tertiärstruktur) bestimmt.
Im menschlichen Körper unter dem Einfluss von Proteinase- und Peptidase-Enzymen Proteineigenschaften in der Nahrung werden sie hauptsächlich in freie Aminosäuren zerlegt. Es kommt im Darm vor und ist eine wichtige Eigenschaft von Proteinen. In der Mundhöhle wird zerkleinerte Nahrung durch das im Speichel enthaltene Enzym Amylase verarbeitet. Amylase baut Kohlenhydrate, einschließlich pflanzlicher Kohlenhydrate, ab, die mit den chemischen Eigenschaften von Proteinen verbunden sind, wodurch Proteine für die weitere Verarbeitung freigesetzt werden.
Allgemeine Eigenschaften von Proteinen
Im Magen, wo Salzsäure und Pepsin ausgeschieden werden, kommt es unter dem Einfluss erhöhter Säure und des Enzyms zu einer teilweisen Denaturierung (Änderung der Tertiärstruktur) der Eigenschaften des Proteins und seiner Aufspaltung in große Fragmente. Im Darm werden teilweise hydrolysierte Proteine durch Proteasen und Peptidasen hauptsächlich zu Aminosäuren gespalten, die ins Blut aufgenommen und dann durch den Körper transportiert werden, wodurch das Verhältnis beeinflusst wird, das die Proteinnorm für einen Menschen beschreibt. Einige Aminosäuren werden zum Aufbau verwendet chemische Eigenschaften von Proteinen andere werden im Körper in Verbindungen umgewandelt, die an der Bildung bestimmter wichtiger organischer Substanzen wie Nukleoproteine usw. beteiligt sind.
Ein gewisser Teil der Aminosäuren wird zu organischen Ketosäuren abgebaut, aus denen im Körper neue Aminosäuren und dann Proteine synthetisiert werden, ein wichtiger Prozess, wenn letztlich die Eigenschaften von Proteinen eine wichtige Rolle spielen. Diese Aminosäuren werden als nicht essentiell bezeichnet. Allerdings können 8 Aminosäuren, nämlich: Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Tryptophan, Trenin und Valin - in Bezug auf die Eigenschaften des Proteins im Körper eines Erwachsenen nicht aus anderen gebildet werden.
Eichhörnchen- hochmolekulare organische Verbindungen, bestehend aus Resten von α-Aminosäuren.
BEI Proteinzusammensetzung beinhaltet Kohlenstoff, Wasserstoff, Stickstoff, Sauerstoff, Schwefel. Einige Proteine bilden Komplexe mit anderen Molekülen, die Phosphor, Eisen, Zink und Kupfer enthalten.
Proteine haben ein großes Molekulargewicht: Eialbumin - 36.000, Hämoglobin - 152.000, Myosin - 500.000 Zum Vergleich: Das Molekulargewicht von Alkohol beträgt 46, Essigsäure - 60, Benzol - 78.
Aminosäurezusammensetzung von Proteinen
Eichhörnchen– nicht periodische Polymere, deren Monomere sind α-Aminosäuren. Normalerweise werden 20 Arten von α-Aminosäuren als Proteinmonomere bezeichnet, obwohl mehr als 170 davon in Zellen und Geweben gefunden wurden.
Abhängig davon, ob Aminosäuren im Körper von Menschen und anderen Tieren synthetisiert werden können, gibt es: nicht essentielle Aminosäuren- kann synthetisiert werden essentielle Aminosäuren- kann nicht synthetisiert werden. Essentielle Aminosäuren müssen mit der Nahrung aufgenommen werden. Pflanzen synthetisieren alle Arten von Aminosäuren.
Je nach Aminosäurezusammensetzung Proteine sind: vollständig- den gesamten Satz von Aminosäuren enthalten; defekt- Einige Aminosäuren fehlen in ihrer Zusammensetzung. Wenn Proteine nur aus Aminosäuren bestehen, werden sie genannt einfach. Enthalten Proteine neben Aminosäuren auch einen Nicht-Aminosäure-Anteil (eine prosthetische Gruppe), werden sie genannt Komplex. Die prosthetische Gruppe kann durch Metalle (Metalloproteine), Kohlenhydrate (Glykoproteine), Lipide (Lipoproteine), Nukleinsäuren (Nukleoproteine) dargestellt werden.
Alle Aminosäuren enthalten: 1) eine Carboxylgruppe (-COOH), 2) eine Aminogruppe (-NH 2), 3) ein Radikal oder eine R-Gruppe (der Rest des Moleküls). Die Struktur des Radikals in verschiedenen Arten von Aminosäuren ist unterschiedlich. Abhängig von der Anzahl der Aminogruppen und Carboxylgruppen, aus denen Aminosäuren bestehen, gibt es: neutrale Aminosäuren mit einer Carboxylgruppe und einer Aminogruppe; basische Aminosäuren mit mehr als einer Aminogruppe; saure Aminosäuren mit mehr als einer Carboxylgruppe.
Aminosäuren sind amphotere Verbindungen, da sie in Lösung sowohl als Säuren als auch als Basen wirken können. In wässrigen Lösungen liegen Aminosäuren in verschiedenen ionischen Formen vor.
Peptidbindung
Peptide- organische Substanzen, die aus Aminosäureresten bestehen, die durch eine Peptidbindung verbunden sind.
Die Bildung von Peptiden erfolgt als Ergebnis der Kondensationsreaktion von Aminosäuren. Wenn die Aminogruppe einer Aminosäure mit der Carboxylgruppe einer anderen interagiert, entsteht zwischen ihnen eine kovalente Stickstoff-Kohlenstoff-Bindung, die als bezeichnet wird Peptid. Abhängig von der Anzahl der Aminosäurereste, aus denen das Peptid besteht, gibt es Dipeptide, Tripeptide, Tetrapeptide usw. Die Bildung einer Peptidbindung kann viele Male wiederholt werden. Dies führt zur Bildung Polypeptide. An einem Ende des Peptids befindet sich eine freie Aminogruppe (wird als N-Terminus bezeichnet) und am anderen Ende befindet sich eine freie Carboxylgruppe (wird als C-Terminus bezeichnet).

Räumliche Organisation von Proteinmolekülen
Die Erfüllung bestimmter spezifischer Funktionen durch Proteine hängt von der räumlichen Konfiguration ihrer Moleküle ab. Außerdem ist es für die Zelle energetisch ungünstig, Proteine in einer erweiterten Form in Form einer Kette zu halten. Daher werden Polypeptidketten gefaltet und erworben eine bestimmte dreidimensionale Struktur oder Konformation. Weisen Sie 4 Ebenen zu Räumliche Organisation von Proteinen.
Primärstruktur eines Proteins- die Sequenz der Aminosäurereste in der Polypeptidkette, aus der das Proteinmolekül besteht. Die Bindung zwischen Aminosäuren ist Peptid.

Wenn ein Proteinmolekül nur aus 10 Aminosäureresten besteht, dann beträgt die Anzahl der theoretisch möglichen Varianten von Proteinmolekülen, die sich in der Reihenfolge der Aminosäuren abwechseln, 10 20 . Mit 20 Aminosäuren können Sie noch vielfältigere Kombinationen daraus machen. Im menschlichen Körper wurden etwa zehntausend verschiedene Proteine gefunden, die sich sowohl untereinander als auch von den Proteinen anderer Organismen unterscheiden.
Es ist die Primärstruktur des Proteinmoleküls, die die Eigenschaften der Proteinmoleküle und ihre räumliche Anordnung bestimmt. Der Austausch nur einer Aminosäure gegen eine andere in der Polypeptidkette führt zu einer Veränderung der Eigenschaften und Funktionen des Proteins. Beispielsweise führt der Ersatz der sechsten Glutaminaminosäure in der β-Untereinheit des Hämoglobins durch Valin dazu, dass das Hämoglobinmolekül als Ganzes seine Hauptfunktion - den Sauerstofftransport - nicht erfüllen kann; In solchen Fällen entwickelt eine Person eine Krankheit - Sichelzellenanämie.
sekundäre Struktur- geordnete Faltung der Polypeptidkette zu einer Spirale (sieht aus wie eine gespannte Feder). Die Windungen der Helix werden durch Wasserstoffbrückenbindungen zwischen Carboxylgruppen und Aminogruppen verstärkt. Nahezu alle CO- und NH-Gruppen sind an der Bildung von Wasserstoffbrückenbindungen beteiligt. Sie sind schwächer als Peptide, aber sie wiederholen sich viele Male und verleihen dieser Konfiguration Stabilität und Starrheit. Auf der Ebene der Sekundärstruktur befinden sich Proteine: Fibroin (Seide, Gewebe), Keratin (Haare, Nägel), Kollagen (Sehnen).



Tertiärstruktur- Verpackung von Polypeptidketten in Kügelchen, die aus dem Auftreten chemischer Bindungen (Wasserstoff, Ionen, Disulfid) und der Bildung hydrophober Wechselwirkungen zwischen Radikalen von Aminosäureresten resultieren. Die Hauptrolle bei der Bildung der Tertiärstruktur spielen hydrophil-hydrophobe Wechselwirkungen. In wässrigen Lösungen neigen hydrophobe Radikale dazu, sich vor Wasser zu verstecken und sich innerhalb der Kügelchen zu gruppieren, während hydrophile Radikale dazu neigen, als Ergebnis der Hydratation (Wechselwirkung mit Wasserdipolen) auf der Oberfläche des Moleküls zu erscheinen. Bei einigen Proteinen wird die Tertiärstruktur durch kovalente Disulfidbindungen stabilisiert, die sich zwischen den Schwefelatomen der beiden Cysteinreste bilden. Auf der Ebene der Tertiärstruktur gibt es Enzyme, Antikörper und einige Hormone.

Quartäre Struktur charakteristisch für komplexe Proteine, deren Moleküle aus zwei oder mehr Kügelchen bestehen. Untereinheiten werden im Molekül durch ionische, hydrophobe und elektrostatische Wechselwirkungen gehalten. Manchmal treten während der Bildung einer Quartärstruktur Disulfidbindungen zwischen Untereinheiten auf. Das am besten untersuchte Protein mit Quartärstruktur ist Hämoglobin. Es besteht aus zwei α-Untereinheiten (141 Aminosäurereste) und zwei β-Untereinheiten (146 Aminosäurereste). Jede Untereinheit ist mit einem eisenhaltigen Hämmolekül assoziiert.
Wenn aus irgendeinem Grund die räumliche Konformation von Proteinen vom Normalzustand abweicht, kann das Protein seine Funktionen nicht erfüllen. So ist beispielsweise die Ursache des „Rinderwahns“ (spongiforme Enzephalopathie) eine abnormale Konformation von Prionen, den Oberflächenproteinen von Nervenzellen.
Proteineigenschaften
Die Aminosäurezusammensetzung bestimmt die Struktur des Eiweißmoleküls Eigenschaften. Proteine vereinen durch Aminosäurereste bedingte basische und saure Eigenschaften: Je mehr saure Aminosäuren in einem Protein enthalten sind, desto ausgeprägter sind seine sauren Eigenschaften. Die Fähigkeit, H + zu geben und zu binden, bestimmen Puffereigenschaften von Proteinen; Einer der stärksten Puffer ist Hämoglobin in Erythrozyten, das den pH-Wert des Blutes auf einem konstanten Niveau hält. Es gibt lösliche Proteine (Fibrinogen), es gibt unlösliche Proteine, die mechanische Funktionen erfüllen (Fibroin, Keratin, Kollagen). Es gibt chemisch aktive Proteine (Enzyme), es gibt chemisch inaktive, resistent gegen verschiedene Umweltbedingungen und extrem instabil.
Äußere Faktoren (Hitze, UV-Strahlung, Schwermetalle und deren Salze, pH-Änderungen, Strahlung, Austrocknung)
kann eine Verletzung der strukturellen Organisation des Proteinmoleküls verursachen. Der Prozess des Verlusts der dreidimensionalen Konformation, die einem bestimmten Proteinmolekül innewohnt, wird als bezeichnet Denaturierung. Ursache der Denaturierung ist das Aufbrechen von Bindungen, die eine bestimmte Proteinstruktur stabilisieren. Anfangs werden die schwächsten Bindungen zerrissen, und wenn die Bedingungen härter werden, dann noch stärkere. Daher gehen zuerst die Quartär-, dann die Tertiär- und Sekundärstrukturen verloren. Eine Veränderung der räumlichen Konfiguration führt zu einer Veränderung der Eigenschaften des Proteins und macht es dem Protein dadurch unmöglich, seine biologischen Funktionen zu erfüllen. Wenn die Denaturierung nicht von der Zerstörung der Primärstruktur begleitet wird, dann kann es sein reversibel, tritt in diesem Fall eine Selbstheilung der für das Protein charakteristischen Konformation auf. Einer solchen Denaturierung unterliegen beispielsweise Membranrezeptorproteine. Der Prozess der Wiederherstellung der Struktur eines Proteins nach der Denaturierung wird als Renaturierung. Wenn die Wiederherstellung der räumlichen Konfiguration des Proteins unmöglich ist, wird eine Denaturierung genannt irreversibel.
Funktionen von Proteinen
| Funktion | Beispiele und Erläuterungen |
|---|---|
| Konstruktion | Proteine sind an der Bildung zellulärer und extrazellulärer Strukturen beteiligt: Sie sind Bestandteil von Zellmembranen (Lipoproteine, Glykoproteine), Haare (Keratin), Sehnen (Kollagen) etc. |
| Transport | Das Blutprotein Hämoglobin bindet Sauerstoff und transportiert ihn von der Lunge zu allen Geweben und Organen, und von dort gelangt Kohlendioxid in die Lunge; Die Zusammensetzung der Zellmembranen umfasst spezielle Proteine, die einen aktiven und streng selektiven Transfer bestimmter Substanzen und Ionen von der Zelle in die äußere Umgebung und zurück ermöglichen. |
| Regulierung | Eiweißhormone sind an der Regulation von Stoffwechselvorgängen beteiligt. So reguliert das Hormon Insulin beispielsweise den Blutzuckerspiegel, fördert die Glykogensynthese und erhöht die Bildung von Fetten aus Kohlenhydraten. |
| Schützend | Als Reaktion auf das Eindringen von fremden Proteinen oder Mikroorganismen (Antigenen) in den Körper werden spezielle Proteine gebildet - Antikörper, die sie binden und neutralisieren können. Fibrin, gebildet aus Fibrinogen, hilft Blutungen zu stoppen. |
| Motor | Die kontraktilen Proteine Aktin und Myosin sorgen bei vielzelligen Tieren für Muskelkontraktion. |
| Signal | In die Oberflächenmembran der Zelle sind Proteinmoleküle eingebettet, die in der Lage sind, ihre Tertiärstruktur als Reaktion auf die Einwirkung von Umweltfaktoren zu ändern, wodurch Signale von der äußeren Umgebung empfangen und Befehle an die Zelle übermittelt werden. |
| Reservieren | Im Körper von Tieren werden Proteine in der Regel nicht gespeichert, mit Ausnahme von Eialbumin und Milchkasein. Aber dank Proteinen im Körper können einige Substanzen in Reserve gespeichert werden, zum Beispiel wird Eisen während des Abbaus von Hämoglobin nicht aus dem Körper ausgeschieden, sondern gespeichert und bildet einen Komplex mit dem Ferritin-Protein. |
| Energie | Beim Abbau von 1 g Protein zu den Endprodukten werden 17,6 kJ freigesetzt. Zuerst zerfallen Proteine in Aminosäuren und dann in die Endprodukte - Wasser, Kohlendioxid und Ammoniak. Proteine werden jedoch nur dann als Energiequelle genutzt, wenn andere Quellen (Kohlenhydrate und Fette) aufgebraucht sind. |
| katalytisch | Eine der wichtigsten Funktionen von Proteinen. Versehen mit Proteinen - Enzymen, die die biochemischen Reaktionen beschleunigen, die in Zellen ablaufen. Beispielsweise katalysiert Ribulose-Bisphosphat-Carboxylase die CO2-Fixierung während der Photosynthese. |
Enzyme
Enzyme, oder Enzyme, ist eine spezielle Klasse von Proteinen, die biologische Katalysatoren sind. Dank Enzymen laufen biochemische Reaktionen mit enormer Geschwindigkeit ab. Die Geschwindigkeit enzymatischer Reaktionen ist zehntausendmal (und manchmal millionenfach) höher als die Geschwindigkeit von Reaktionen mit anorganischen Katalysatoren. Die Substanz, auf die ein Enzym einwirkt, heißt Substrat.
Enzyme sind globuläre Proteine strukturelle Eigenschaften Enzyme können in zwei Gruppen eingeteilt werden: einfache und komplexe. einfache Enzyme sind einfache Proteine, d.h. bestehen nur aus Aminosäuren. Komplexe Enzyme sind komplexe Proteine, d.h. Zusätzlich zum Proteinteil umfassen sie eine Gruppe von Nicht-Proteinnatur - Cofaktor. Für einige Enzyme wirken Vitamine als Cofaktoren. Im Enzymmolekül ist ein spezieller Teil isoliert, das sogenannte aktive Zentrum. aktives Zentrum- ein kleiner Abschnitt des Enzyms (von drei bis zwölf Aminosäureresten), wo die Bindung des Substrats oder der Substrate mit der Bildung des Enzym-Substrat-Komplexes erfolgt. Nach Beendigung der Reaktion zerfällt der Enzym-Substrat-Komplex in ein Enzym und ein oder mehrere Reaktionsprodukte. Einige Enzyme haben (außer aktiv) allosterische Zentren- Stellen, an denen Regulatoren der Geschwindigkeit der Enzymarbeit angebracht sind ( allosterische Enzyme).

Enzymatische Katalysereaktionen sind gekennzeichnet durch: 1) hohe Effizienz, 2) strikte Selektivität und Wirkungsrichtung, 3) Substratspezifität, 4) feine und präzise Regulation. Die Substrat- und Reaktionsspezifität enzymatischer Katalysereaktionen wird durch die Hypothesen von E. Fischer (1890) und D. Koshland (1959) erklärt.
E. Fisher (Schlüssel-Schloss-Hypothese) schlugen vor, dass die räumlichen Konfigurationen des aktiven Zentrums des Enzyms und des Substrats exakt einander entsprechen sollten. Das Substrat wird mit dem „Schlüssel“, das Enzym mit dem „Schloss“ verglichen.
D. Koshland (Hypothese "Handschuh") schlugen vor, dass die räumliche Korrespondenz zwischen der Struktur des Substrats und dem aktiven Zentrum des Enzyms erst im Moment ihrer Wechselwirkung miteinander hergestellt wird. Diese Hypothese wird auch genannt induzierte Anpassungshypothese.
Die Geschwindigkeit enzymatischer Reaktionen hängt ab von: 1) Temperatur, 2) Enzymkonzentration, 3) Substratkonzentration, 4) pH. Es sollte betont werden, dass, da Enzyme Proteine sind, ihre Aktivität unter physiologisch normalen Bedingungen am höchsten ist.
Die meisten Enzyme können nur bei Temperaturen zwischen 0 und 40°C arbeiten. Innerhalb dieser Grenzen erhöht sich die Reaktionsgeschwindigkeit pro 10 °C Temperaturanstieg um etwa das 2-fache. Bei Temperaturen über 40 °C wird das Protein denaturiert und die Aktivität des Enzyms lässt nach. Bei Temperaturen nahe dem Gefrierpunkt werden die Enzyme inaktiviert.
Mit zunehmender Substratmenge steigt die Geschwindigkeit der enzymatischen Reaktion, bis die Anzahl der Substratmoleküle gleich der Anzahl der Enzymmoleküle wird. Bei einer weiteren Erhöhung der Substratmenge erhöht sich die Geschwindigkeit nicht, da die aktiven Zentren des Enzyms gesättigt sind. Eine Erhöhung der Enzymkonzentration führt zu einer Erhöhung der katalytischen Aktivität, da eine größere Anzahl von Substratmolekülen pro Zeiteinheit umgesetzt werden.

Für jedes Enzym gibt es einen optimalen pH-Wert, bei dem es seine maximale Aktivität zeigt (Pepsin – 2,0, Speichelamylase – 6,8, Pankreaslipase – 9,0). Bei höheren oder niedrigeren pH-Werten nimmt die Aktivität des Enzyms ab. Bei starken pH-Verschiebungen denaturiert das Enzym.
Die Geschwindigkeit allosterischer Enzyme wird durch Substanzen reguliert, die sich an allosterische Zentren anlagern. Wenn diese Substanzen die Reaktion beschleunigen, werden sie gerufen Aktivatoren wenn sie langsamer werden - Inhibitoren.
Enzymklassifizierung
Je nach Art der katalysierten chemischen Umwandlungen werden Enzyme in 6 Klassen eingeteilt:
- Oxidoreduktase(Übertragung von Wasserstoff-, Sauerstoff- oder Elektronenatomen von einer Substanz auf eine andere - Dehydrogenase),
- transferase(Übertragung einer Methyl-, Acyl-, Phosphat- oder Aminogruppe von einer Substanz auf eine andere - Transaminase),
- Hydrolasen(Hydrolysereaktionen, bei denen aus dem Substrat zwei Produkte gebildet werden - Amylase, Lipase),
- Lyasen(nicht hydrolytische Addition an das Substrat oder die Eliminierung einer Gruppe von Atomen daraus, während C-C-, C-N-, C-O-, C-S-Bindungen gebrochen werden können - Decarboxylase),
- Isomerase(intramolekulare Umlagerung - Isomerase),
- Ligasen(die Verbindung zweier Moleküle durch die Bildung von C-C-, C-N-, C-O-, C-S-Bindungen - Synthetase).
Klassen werden wiederum in Unterklassen und Unterunterklassen unterteilt. In der aktuellen internationalen Klassifikation hat jedes Enzym einen spezifischen Code, der aus vier Zahlen besteht, die durch Punkte getrennt sind. Die erste Zahl ist die Klasse, die zweite ist die Unterklasse, die dritte ist die Unterklasse, die vierte ist die Seriennummer des Enzyms in dieser Unterklasse, zum Beispiel ist der Arginase-Code 3.5.3.1.
Gehe zu Vorlesung Nummer 2"Die Struktur und Funktionen von Kohlenhydraten und Lipiden"
Gehe zu Vorlesungen №4"Die Struktur und Funktionen von ATP-Nukleinsäuren"
Die Zusammensetzung von Proteinen umfasst organogene Elemente und Schwefel. Einige Proteine enthalten Phosphor, Selen, Metalle usw. Der Prozentsatz an chemischen Elementen in Proteinen kann je nach Gewebe oder Organ innerhalb der in der Tabelle angegebenen Grenzen variieren. 1.2.
Da Proteine Polymere sind, sind sie eine Kette von Aminosäuren. Die Aminosäuresequenz in einem Proteinmolekül ist immer genetisch festgelegt. Gleichzeitig ist eine Aneinanderreihung von Aminosäuren noch kein Protein als solches; es ist nicht in der Lage, die Funktionen eines Proteins zu erfüllen. Proteine sind in einer lebenden Zelle keine formlosen Aminosäurestränge, sondern ausschließlich strukturierte Gebilde mit einer bestimmten räumlichen Anordnung.
Tabelle 1.2
Bei der räumlichen Organisation eines Proteinmoleküls werden vier Ebenen unterschieden. Primärstruktur - Kette von Aminosäuren. Sekundärstruktur - die Aminosäurekette ist in Form einer a-Helix verdrillt. Tertiärstruktur- Die räumliche Anordnung der Polypeptidkette kann in Form einer Spirale (globuläre Proteine) oder in Form einer Faser (fibrilläre Proteine) erfolgen (Abb. 1.4). Globuläre Proteine sind in Wasser sehr gut löslich, dazu gehören Eiweiß, Milchkasein, Blutplasmaproteine. Fibrillenproteine sind entweder wasserunlöslich oder schwerlöslich; dazu gehören Proteine in Muskeln, Knochen und einige Blutproteine (Fibrin). Quartäre Struktur- die Assoziation mehrerer Polypeptidketten, die unterschiedliche Primär-, Sekundär- und Tertiärstrukturen aufweisen können.
Abhängig von der Struktur der Tertiär- und Quartärstruktur werden Proteine in einfache und komplexe unterteilt. Einfache Proteine - Proteine nur aus Aminosäuren zusammengesetzt, komplexe Proteine - Proteine enthalten Eiweiß- und Nichteiweißteile. Nicht-Protein-Teil - Cofaktor können durch Nucleinsäuren, Lipide, Zucker, Vitamine, Phosphorsäure und andere Verbindungen dargestellt werden.
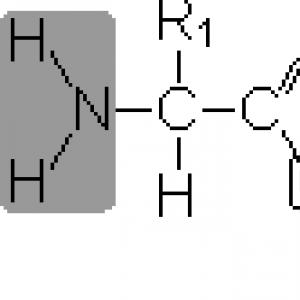
Die Eigenschaften und die Struktur eines Proteins werden durch die darin enthaltenen Aminosäuren, ihre Gesamtzahl, die Reihenfolge der Verbindungen untereinander und die räumliche Konfiguration des Moleküls selbst bestimmt. Eine Aminosäure ist eine kleine organische Verbindung, die zwei funktionelle Gruppen enthält, von denen eine saure Eigenschaften hat - eine Carboxylgruppe, die andere - eine Aminogruppe, die als Base wirkt. Die allgemeine Strukturformel lautet wie folgt:
COOH - Carboxylgruppe;
NH 2 - Aminogruppe;
R ist ein Radikal.
Die grau markierte Gruppe ist in allen Aminosäuren in unveränderter Form vorhanden, und der Rest für jede Aminosäure hat seinen eigenen - je nach Struktur des Rests unterscheiden sich Aminosäuren nämlich voneinander
Derzeit sind etwa 200 Aminosäuren bekannt, aber nur 20 davon sind im Protein enthalten (Tab. 1.3), weshalb sie auch genannt werden
"magische Aminosäuren". Der Hauptzweck von Aminosäuren ist die Teilnahme am Aufbau von Proteinmolekülen im Körper. Aber abgesehen davon erfüllen Aminosäuren unabhängig voneinander eine Vielzahl von Funktionen, die in der Tabelle dargestellt sind. 1.3.
Einige dieser Aminosäuren, nämlich 12, können im menschlichen Körper in ausreichender oder begrenzter Menge synthetisiert werden. Als Aminosäuren werden Aminosäuren bezeichnet, die im Körper in ausreichender Menge synthetisiert werden nicht essentielle Aminosäuren. Diese beinhalten Alanin, Asparagin, Asparaginsäure, Glycin, Glutamin, Glutaminsäure, Prolin, Serin, Tyrosin, Cystein. Aminosäuren, die im Körper in begrenzten Mengen synthetisiert werden, werden als Aminosäuren bezeichnet teilweise austauschbare Aminosäuren. Diese Aminosäuren sind Arginin und Histidin, bei einem Erwachsenen werden sie in der erforderlichen Menge und bei Kindern in unzureichenden Mengen synthetisiert.
Tabelle 1.3
Kurze Beschreibung der Aminosäuren
|
Name |
Funktion |
Quelle |
brauchen, g |
|
Nicht essentielle Aminosäuren |
|||
|
Alanin |
In der Leber in Glukose umgewandelt, die am Prozess der Gluconeogenese beteiligt ist |
Hafergrütze, Reisgrütze, Milch und Molkereiprodukte, Rindfleisch, Lachs |
|
|
Arginin |
Beteiligt sich am Proteinstoffwechsel (Ornithinzyklus). Beschleunigt die Wundheilung. Verhindert die Bildung von Tumoren. Reinigt die Leber, stärkt das Immunsystem |
Walnüsse, Pinienkerne, Kürbiskerne, Sonnenblumenkerne, Sesam, Sojabohnen, Milch, Fleisch, Fisch |
|
|
Asparagin |
Beteiligt sich an Transaminierungsreaktionen. Es spielt eine wichtige Rolle bei der Synthese von Ammoniak. Asparaginsäure-Vorläufer |
Hülsenfrüchte, Spargel, Tomaten, Nüsse, Samen, Milch, Fleisch, Eier, Fisch, Meeresfrüchte |
|
|
Asparaginsäure |
Beteiligt sich am Prozess der Glukoneogenese und der anschließenden Speicherung von Glykogen, an den Prozessen der DNA- und RNA-Synthese. Beschleunigt die Produktion von Immunglobulinen |
Kartoffeln, Kokosnüsse, Nüsse, Rindfleisch, Käse, Eier |
|
Fortsetzung
|
Name |
Funktion |
Quelle |
brauchen, g |
|
Histidin |
Beteiligt sich an der Bildung der Immunantwort, an den Prozessen der Hämatopoese |
Getreide, Reis, Fleisch |
|
|
Glycin |
Beteiligt sich an der Produktion von Hormonen. Es ist ein Rohstoff für die Produktion anderer Aminosäuren. Hemmt die Weiterleitung von Nervenimpulsen. Aktiviert das Immunsystem |
Petersilie, Fleischprodukte, Milchprodukte, Fisch |
|
|
Glutamin |
Es ist ein Vorläufer der Glutaminsäure. Beteiligt sich an der Arbeit der Zellen des Dünndarms und des Immunsystems. Verbessert das Gedächtnis |
Kartoffeln, Getreide, Sojabohnen, Walnüsse, Schweinefleisch, Rindfleisch, Milch |
|
|
Glutaminsäure |
Spielt eine wichtige Rolle im Stickstoffstoffwechsel. Beteiligt sich an der Übertragung von Kaliumionen in die Zellen des Zentralnervensystems und neutralisiert Ammoniak. Beteiligt sich an der Normalisierung des Blutzuckers |
Spinat, Fleisch, Milch, Fisch, Käse |
|
|
Prolin |
Beteiligt sich an der Synthese von Kollagen. Fördert die Wundheilung, verbessert die Hautstruktur |
Fleisch, Milchprodukte, Fisch, Eier |
|
|
Heiter |
Beteiligt sich an der Bildung aktiver Zentren einer Reihe von Enzymen, der Synthese von Aminosäuren. Erforderlich für den Stoffwechsel von Fettsäuren und Fetten |
Milchprodukte |
|
|
Tyrosin |
Beteiligt sich an der Biosynthese von Melaninen, Dopamin, Adrenalin, Schilddrüsenhormonen. Stimuliert die Gehirnaktivität |
Sesamsamen, Kürbiskerne, Mandeln, Früchte, Milchprodukte |
Fortsetzung
|
Name |
Funktion |
Quelle |
brauchen, g |
|
Cystein |
Beteiligt sich an der Bildung der Tertiärstruktur von Proteinmolekülen. Es hat antioxidative, antikarzinogene und entgiftende Eigenschaften. Beteiligt sich am Fettstoffwechsel |
Zwiebel, Knoblauch, Paprika, Milchprodukte, Fleisch, Fisch (Lachs), Käse |
|
|
Essentielle Aminosäuren |
|||
|
Valin |
Stimuliert geistige Aktivität, Aktivität und Koordination. Energiequelle für Muskeln. |
Milchprodukte, Fleisch, Kaviar, Getreide, Getreide, Hülsenfrüchte, Pilze, Nüsse |
|
|
Isoleucin |
Normalisiert die Funktionen des zentralen Nervensystems |
Milchprodukte, Fleisch, Fisch, Eier, Nüsse, Soja, Roggen, Linsen |
|
|
Leucin |
Fördert die Wiederherstellung von Knochen, Haut, Muskeln. Senkt den Blutzuckerspiegel und stimuliert die Freisetzung von Wachstumshormonen. Wichtiges Zwischenprodukt bei der Cholesterinsynthese |
Hülsenfrüchte, Reis, Weizen, Nüsse, Fleisch |
|
|
Lysin |
Beteiligt sich am Kalziumstoffwechsel, an der Bildung von Kollagen. Erforderlich für Wachstum, Gewebereparatur, Synthese von Hormonen, Antikörpern |
Kartoffeln, Äpfel, Milchprodukte, Fleisch, Fisch, Käse |
|
|
Methionin |
Beteiligt sich am Stoffwechsel von Fetten, Vitaminen, Phospholipiden. Notwendig für die Bildung von Haaren, Haut und Nägeln. Hat eine lipotrope Wirkung |
Mais, Hüttenkäse, Eier, Fisch (Barsch, Wels, Sternstör, Kabeljau), Leber |
|
|
Threonin |
Verhindert die Ablagerung von Fett in der Leber. Fördert die Bildung von Kollagen, Elastin und Zahnschmelzproteinen. Stärkt die Immunabwehr |
Nüsse, Samen, Hülsenfrüchte, Milchprodukte, Eier, Fleisch, Fisch (Lachs), pflanzliche Lebensmittel |
|
Die restlichen acht Aminosäuren können im Körper von Mensch und Tier nicht synthetisiert werden und müssen mit der Nahrung zugeführt werden, weshalb sie genannt werden essentielle Aminosäuren. Diese beinhalten Valin, Isoleucin, Leucin, Lysin, Threonin, Tryptophan, Phenylalanin und Methionin. Separat sollten zwei Aminosäuren unterschieden werden - Tyrosin und Cystein, die teilweise ersetzbar sind, aber nicht, weil der Körper sie nicht synthetisieren kann, sondern weil essentielle Aminosäuren für die Bildung dieser Aminosäuren notwendig sind. Tyrosin wird aus Phenylalanin synthetisiert, und die Bildung von Cystein erfordert Schwefel, den es von Methionin entlehnt. Die obigen Informationen können durch das Diagramm in Abb. 1.5.

Proteine sind komplexe organische Verbindungen, die aus Aminosäuren bestehen. Chemische Analysen haben gezeigt, dass Proteine aus folgenden Elementen bestehen:
Kohlenstoff 50-55 %
Wasserstoff 6-7%
Sauerstoff 21-23 %
Stickstoff 15-17 %
Schwefel 0,3-2,5 %.
Auch Phosphor, Jod, Eisen, Kupfer und andere Makro- und Mikrosubstanzen wurden in der Zusammensetzung einzelner Proteine gefunden.
Der Gehalt der wichtigsten chemischen Elemente kann in einzelnen Proteinen variieren, mit Ausnahme von Stickstoff, dessen durchschnittliche Menge sich durch die größte Konstanz auszeichnet und 16% beträgt. In diesem Zusammenhang gibt es eine Möglichkeit, die Menge an Protein in seinem Bestandteil Stickstoff zu bestimmen. Wenn Sie wissen, dass 6,25 Gramm Protein 1 Gramm Stickstoff enthalten, können Sie die Proteinmenge ermitteln, indem Sie die gefundene Stickstoffmenge mit dem Faktor 6,25 multiplizieren.
2. 4. Aminosäuren.
Aminosäuren - Carbonsäuren, deren alpha-Kohlenstoff-Wasserstoffatom durch eine Aminogruppe ersetzt ist. Proteine bestehen aus Aminosäuren. Derzeit sind mehr als 200 verschiedene Aminosäuren bekannt. Es gibt etwa 60 davon im menschlichen Körper, und Proteine enthalten nur 20 Aminosäuren, die als bezeichnet werden natürlich oder proteinogen. Davon sind 19 Alpha-Aminosäuren, was bedeutet, dass die Aminogruppe an das Alpha-Kohlenstoffatom der Carbonsäure gebunden ist. Die allgemeine Formel dieser Aminosäuren ist wie folgt.
Nur die Aminosäure Prolin entspricht nicht dieser Formel, sie wird als Iminosäure bezeichnet.
Die chemischen Namen von Aminosäuren werden der Kürze halber abgekürzt, zum Beispiel Glutaminsäure GLU, Serin SEP usw. In letzter Zeit wurden nur Ein-Buchstaben-Symbole verwendet, um die Primärstruktur von Proteinen aufzuzeichnen.
Alle Aminosäuren haben gemeinsame Gruppen: -CH2, -NH2, -COOH, sie verleihen Proteinen und Radikalen gemeinsame chemische Eigenschaften, deren chemische Natur vielfältig ist. Sie bestimmen die strukturellen und funktionellen Eigenschaften von Aminosäuren.
Die Klassifizierung von Aminosäuren basiert auf ihren physikalisch-chemischen Eigenschaften.
Nach der Struktur der Radikale:
Zyklisch - homozyklisches FEN, TIR, heterozyklisches SRI, GIS.
Acyclisch – Monoaminomonocarbonsäure GLI, ALA, SURE, CIS, TRE, MET, SHAFT, LEY, ILEY, NLEY, Monoaminodicarbonsäure ASP, GLU, Diaminomonocarbonsäure LIZ, ARG.
Durch Bildung im Körper:
Ersetzbar - kann im Körper aus Substanzen mit Protein- und Nichtproteinnatur synthetisiert werden.
Essentiell - können nicht im Körper synthetisiert werden, also müssen sie nur mit der Nahrung aufgenommen werden - alle zyklischen Aminosäuren, TPE, VAL, LEY, ILEY.
Die biologische Bedeutung von Aminosäuren:
Sie gehören zu den Proteinen des menschlichen Körpers.
Sie sind Teil der Peptide des menschlichen Körpers.
Aus Aminosäuren werden im Körper viele niedermolekulare biologisch aktive Substanzen gebildet: GABA, biogene Amine etc.
Ein Teil der Hormone im Körper sind Derivate von Aminosäuren (Schilddrüsenhormone, Adrenalin).
Vorläufer stickstoffhaltiger Basen, aus denen Nukleinsäuren bestehen.
Vorläufer von Porphyrinen, die für die Häm-Biosynthese für Hämoglobin und Myoglobin verwendet werden.
Vorläufer stickstoffhaltiger Basen, die Teil komplexer Lipide sind (Cholin, Ethanolamin).
Beteiligen Sie sich an der Biosynthese von Mediatoren im Nervensystem (Acetylcholin, Dopamin, Serotonin, Noradrenalin usw.).
Eigenschaften von Aminosäuren:
Gut löslich in Wasser.
In einer wässrigen Lösung liegen sie in Form einer Gleichgewichtsmischung aus einem bipolaren Ion, kationischen und anionischen Formen des Moleküls vor. Das Gleichgewicht hängt vom pH-Wert des Mediums ab.
NH3-CH-COOH NH3-CH-COO NH2-CH-COO
R + OH R R + H
Kationische Form Bipolares Ion Anionische Form
Alkalische pH-Säure
Kann sich in einem elektrischen Feld bewegen, das zur Trennung von Aminosäuren mittels Elektrophorese verwendet wird.
Amphotere Eigenschaften zeigen.
Sie können die Rolle eines Puffersystems spielen, weil kann als schwache Base und schwache Säure reagieren.