A pirrol nitrogénatom elektronszerkezete. A légkör nitrogénje A nitrogén grafikus szerkezete
MEGHATÁROZÁS
Nitrogén- a periódusos rendszer hetedik eleme. Nem fémekre utal. Az A csoport V alcsoportjának második periódusában található.
A sorozatszám 7. A nukleáris töltés +7. Atomtömeg - 14.007 amu. A nitrogénnek két izotópja található a természetben: 14 N - 99,635% és 15 N - 0,365% (a százalékos arányuk zárójelben van feltüntetve).
A nitrogénatom elektronszerkezete
A nitrogénatomnak két héja van, mint minden elem, amely a második periódusban található. A -V csoportszám azt jelzi, hogy a nitrogénatom külső elektronszintje 5 vegyértékelektront tartalmaz.
Rizs. 1. A nitrogénatom sematikus felépítése.
Az alapállapot elektronikus konfigurációja a következőképpen van felírva:
1s 2 2s 2 2p 3 .
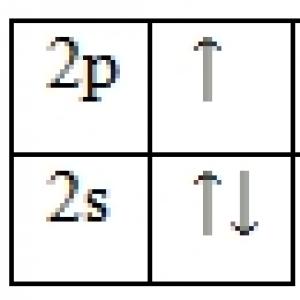
A nitrogén a p-család egyik eleme. A gerjesztetlen állapotban lévő vegyértékelektronok energiadiagramja a következő:

Nincs izgatott állapot. A párosítatlan elektronok száma alapján elmondható, hogy a vegyületekben a nitrogén III vegyértéket mutat. A vegyértéket azonban a csoportszám (V) is meghatározza, ezért a nitrogén két vegyértéket mutathat - III és V.

Rizs. 2. A nitrogénatom szerkezetének térbeli ábrázolása.
Példák problémamegoldásra
1. PÉLDA
Nitrogén a természetbenA levegőben
1%
21%
nitrogén
oxigén
szén-dioxid,
inert gázok
78%
04.02.2018
Kartashova L.A.
Nitrogén körforgás a természetben
04.02.2018Kartashova L.A.
A nitrogén tulajdonságai
Szabad állapotban a nitrogén benne vankétatomos N2 molekulák formájában. Ezekben
molekulák, két nitrogénatom nagyon kötődik
erős hármas kovalens kötés.
N N
N N
A nitrogén színtelen, szagtalan és íztelen gáz. Rosszul
vízben oldódik. Folyékony állapotban (hőm.
forráspont –195,8 °C) – színtelen, mozgékony, hasonló
víz, folyadék. A folyékony nitrogén sűrűsége 808
kg/m³. –209,86 °C-on a nitrogén szilárd anyaggá alakul
állapot hószerű massza formájában ill
nagy hófehér kristályok.
04.02.2018
Kartashova L.A.
A nitrogén tulajdonságai
Normál körülmények között a nitrogén csak vele reagállítium, lítium-nitridet képezve:
6Li+N2=2Li3N
Más fémekkel csak hevítés közben lép reakcióba.
Magas hőmérsékleten, nyomáson és jelenlétében
katalizátor, a nitrogén hidrogénnel reagálva ammóniát képez:
N2 + 3H2 = 2NH3
Az elektromos ív hőmérsékletén csatlakozik a
oxigén, nitrogén-oxidot képez (II):
N2 + O2 = 2NO - Q
04.02.2018
Kartashova L.A.
Nitrogén-oxidok
Nem sóképzőoxid - "nevetőgáz"
Színtelen, nem gyúlékony
gáz kellemes
édeskés illatú és
íz.
Nem sóképző
oxid, színtelen gáz,
rosszul oldódik benne
víz. Nem cseppfolyósodik jól;
folyadékban és szilárdban
a forma kék színű.
savas oxid,
színtelen gáz (nulla helyen)
szilárd formában, kékes színű.
Csak akkor stabil
-4 °C alatti hőmérséklet
Oxid
nitrogén (I)
Oxid
nitrogén(II)
Oxid
nitrogén (III)
savas oxid,
"rókafark" barna,
nagyon mérgező gáz
Oxid
nitrogén (IV)
04.02.2018
Savas oxid.
Színtelen, nagyon
repülő kristályok.
Rendkívül instabil.
Oxid
nitrogén(V)
Kartashova L.A.
Ammónia
NH
H
H
Az ammónia színtelen, szúrós szagú gáz.
majdnem kétszer könnyebb a levegőnél. Ammónia
hosszú ideig nem lélegezhet be,
mert ő mérgező. Az ammónia nagyon jó
vízben oldódik.
Az NH3 ammónia molekulában három kovalens van
poláris kötések nitrogénatom és
hidrogénatomok.
H N H
H
04.02.2018
Kartashova L.A.
vagy
H N H
H
Ammóniatermelés az iparban
04.02.2018Kartashova L.A.
10. Ammónia kinyerése laboratóriumban
04.02.2018Kartashova L.A.
11. Az ammónia nemzetgazdasági felhasználása
04.02.2018Kartashova L.A.
12. Salétromsav
Salétromsav - színtelen, füstölgőfolyadék a levegőben, hőmérséklet
olvadáspont -41,59 °C, forráspont +82,6 °C
részleges bomlással.
A salétromsav oldhatósága vízben
nincs korlátozva.
H O N
04.02.2018
Kartashova L.A.
O
O
13. A salétromsav kémiai tulajdonságai
Tipikus tulajdonságok:a) bázikus és amfoter oxidokkal:
CuO + 2HNO3 = Cu(NO3)2 + H2O
ZnO + 2HNO3 = Cu(NO3)2 + H2O
b) indoklással:
KOH + HNO3 = KNO3+H2O
c) kiszorítja a gyenge savakat sóikból:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
Forraláskor vagy fény hatására salétromsav
részlegesen lebomlik:
4HNO3 = 2H2O + 4NO2 + O2
04.02.2018
Kartashova L.A.
14. A salétromsav kémiai tulajdonságai
1. Fémekkel N-ig1. Fémekkel N-ig
3Zn+8HNO3=3Zn(NO3)2+4H2O+2NO Zn+4HNO3=Zn(NO3)2+2H2O+2NO
2. Fémekkel a H után
2. Fémekkel a H után
3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO Cu+4HNO3=Cu(NO3)2+2H2O+2NO2
3. Nem fémekkel
S+2HNO3=H2SO4+2NO
3. Nem fémekkel
S+6HNO3=H2SO4+6NO2+2H2O
4. Szerves anyagokkal
C2H6+HNO3=C2H5NO2
4. Passziválja a vasat, alumíniumot,
króm
04.02.2018
Kartashova L.A.
15. Salétromsav sók
Sóknitrogén
savak
Nátrium-nitrát
Kalcium-nitrát
Kálium-nitrát
04.02.2018
Ammónium-nitrát
Kartashova L.A.
16. Pótold a hiányzó szavakat!
A periódusos rendszerben D.I. Mengyelejev nitrogénjeperiódusban található, V. csoport, fő
alcsoport. Sorozatszáma 7, relatív
atomtömeg 14.
A vegyületekben a nitrogén oxidációs állapotot mutat
+5, +4, +3, +2, +1, -3. A protonok száma egy nitrogénatomban 7,
elektronok 7, neutronok 7, magtöltés +7,
elektronikus képlet 1s22s22p3 A magasabb képlet
oxid N2O5, jellege savas, képlete
magasabb hidroxid НNO3, illékony képlet
hidrogénvegyület NH3.
04.02.2018
Kartashova L.A.
17. Oszd fel a nitrogénvegyületeket a szervetlen vegyületek osztályaiba!
Oxidokrossz
N.H.
Savak
rossz
NEM
Sók
rossz
NEM
rossz
jobb
jobb
rossz
NaNO
jobb
HNO
rossz
N.H.
jobb
rossz
N2O5
jobb
Al(NO
2)3
jobb
NEM
rossz)
Fe(NO
3 2
jobb
Linóleum
3
HNO3
3
N2O5
rossz
HNO
2
04.02.2018
2
3
HNO2
3
rossz
NEM
2
Kartashova L.A.
2
KNO3
3
3
rossz
NEM
2
5
18. Információforrások
Gabrielyan O. S. Kémia. 9. osztály:http://ru.wikipedia.org/wiki
http://dic.academic.ru/dic.nsf/ruwiki/324035
http://www.catalogmineralov.ru/mineral/50.html
http://chemmarket.info/
http://www.alhimikov.net/video/neorganika/menu.html
04.02.2018
Kartashova L.A.
Az óra során megértheti a "nitrogén" témát. Ismerje meg a nitrogént, mint egyszerű anyagot, az ammóniát, a salétromsavat és a nitrátokat. Figyelembe kell venni ezen anyagok kémiai és fizikai tulajdonságait, molekuláik szerkezetét és más anyagokkal való reakcióit. Ezen túlmenően felsorolásra kerülnek ezen anyagok ipari és laboratóriumi módszerekkel történő előállítási módjai és felhasználásuk a különböző iparágakban. Tekintsük a dinitrogén-oxid és az aqua regia (három rész sósav és egy rész salétromsav kombinációja) tulajdonságait és felhasználását.
Téma: Alapfémek és nemfémek
Tanulság: Nitrogén
1. A nitrogénatom elektronszerkezete
A nitrogén kémiai elem az 5. csoport második periódusában, a fő alcsoportban található. A nitrogénatom elektronkonfigurációja 1s22s22p3. A nitrogénatom vegyértékenergia szintjén nincsenek üres pályák. Következésképpen a 2s alszint elektronpárja nem választható szét. Lásd az ábrát. 1. Ezért a nitrogén nem lehet 5 vegyértékű. A vegyületekben a nitrogén maximális vegyértéke 4. Ebben az esetben 3 kötés jön létre a cseremechanizmussal, és egy a donor-akceptor mechanizmussal. A nitrogén -3 és +5 közötti oxidációs állapotot mutat.
A különböző oxidációs állapotú anyagok példáit lásd az ábrán. 2.

2. A nitrogén egyszerű anyag
Az allotrópia nem jellemző a nitrogénre. Egy egyszerű anyagot képez, az N2-t. Ez egy molekuláris anyag kovalens nempoláris kötéssel. A kötést három közös elektronpár, egy hármas kötés - egy szigma és 2 pi kötés - segítségével alakítják ki. A hármas kötés nagyon erős. Ez a molekuláris nitrogén alacsony reakcióképességét okozza.
Fizikai tulajdonságok
A nitrogén színtelen és szagtalan gáz, vízben rosszul oldódik, a levegőnél valamivel könnyebb. A nitrogén egyes anyagokkal reagál, de a reakciókörülmények nagyon kemények (magas hőmérséklet és nyomás, katalizátor használata). Normál körülmények között a nitrogén csak lítiummal reagál, és lítium-nitrid keletkezik.
6Li + N2 = 2Li3N, melynek hidrolízisével ammónia nyerhető.
Salétrom születése - így fordítják a nitrogén szót latinból. Ez a nitrogén neve, egy 7-es rendszámú kémiai elem, amely a periódusos rendszer hosszú változatában a 15. csoporthoz tartozik. Egyszerű anyag formájában eloszlik a Föld légkörében - a légkörben. Különféle nitrogénvegyületek találhatók a földkéregben és az élő szervezetekben, és széles körben használják az iparban, a katonai ügyekben, a mezőgazdaságban és az orvostudományban.
Miért nevezték a nitrogént „fulladásnak” és „élettelennek”?
Amint azt a kémiatörténészek sugallják, Henry Cavendish (1777) szerezte meg először ezt az egyszerű anyagot. A tudós levegőt engedett át forró szénen, és lúgot használt a reakciótermékek elnyelésére. A kísérlet eredményeként a kutató egy színtelen, szagtalan gázt fedezett fel, amely nem reagált a szénnel. Cavendish "fullasztó levegőnek" nevezte, mert nem képes támogatni a légzést és az égést.
Egy modern vegyész elmagyarázná, hogy az oxigén reakcióba lép a szénnel, és szén-dioxidot képez. A levegő maradék „fuldokló” része nagyrészt N 2 molekulákból állt. Cavendish és más tudósok akkor még nem tudtak erről az anyagról, bár a nitrogén- és nitrátvegyületeket akkoriban széles körben használták a háztartásban. A tudós jelentette a szokatlan gázt hasonló kísérleteket végző kollégájának, Joseph Priestley-nek.
Ugyanakkor Karl Scheele felhívta a figyelmet a levegő egy ismeretlen összetevőjére, de nem tudta helyesen megmagyarázni annak eredetét. Csak Daniel Rutherford ismerte fel 1772-ben, hogy a kísérletekben jelenlévő „fojtogató” „szennyezett” gáz a nitrogén. Hogy melyik tudóst tekintsük felfedezettjének, arról a tudománytörténészek még mindig vitatkoznak.
15 évvel Rutherford kísérletei után a híres kémikus, Antoine Lavoisier azt javasolta, hogy a nitrogénre utaló „elromlott” levegő kifejezést egy másikra, a nitrogénre változtassák. Addigra bebizonyosodott, hogy ez az anyag nem ég és nem támogatja a légzést. Ugyanakkor megjelent az orosz „nitrogén” név, amelyet különféleképpen értelmeznek. A kifejezés leggyakrabban azt jelenti, hogy „élettelen”. A későbbi munka megcáfolta az anyag tulajdonságairól szóló közhiedelmet. A nitrogénvegyületek – a fehérjék – az élő szervezetek legfontosabb makromolekulái. Felépítésükhöz a növények a talajból felszívják az ásványi táplálkozás szükséges elemeit - NO 3 2- és NH 4+ ionokat.
A nitrogén kémiai elem
(PS) segít megérteni az atom szerkezetét és tulajdonságait. A periódusos rendszerben elfoglalt pozíció alapján meghatározható az atommag töltése, a protonok és neutronok száma (tömegszám). Figyelni kell az atomtömeg értékére - ez az elem egyik fő jellemzője. A periódusszám az energiaszintek számának felel meg. A periódusos rendszer rövid változatában a csoportszám a külső energiaszinten lévő elektronok számának felel meg. Foglaljuk össze a nitrogén általános jellemzőinek összes adatát a periódusos rendszerben elfoglalt helye szerint:
- Ez egy nem fémes elem, amely a PS jobb felső sarkában található.
- Kémiai szimbólum: N.
- Sorozatszám: 7.
- Relatív atomtömeg: 14,0067.
- Az illékony hidrogénvegyület képlete: NH 3 (ammónia).
- Magasabb N2O5 oxidot képez, amelyben a nitrogén vegyértéke V.
A nitrogénatom szerkezete:
- Alaptöltés: +7.
- Protonok száma: 7; neutronok száma: 7.
- Energiaszintek száma: 2.
- Általános 7; elektronikus képlet: 1s 2 2s 2 2p 3.
A 7-es számú elem stabil izotópjait részletesen tanulmányoztuk, tömegszámuk 14 és 15. A könnyebbik atomtartalma 99,64%. A rövid élettartamú radioaktív izotópok magjai is 7 protont tartalmaznak, a neutronok száma pedig nagyon változó: 4, 5, 6, 9, 10.

Nitrogén a természetben
A Föld légburája egy egyszerű anyag molekuláit tartalmazza, amelyek képlete N 2. A légkör nitrogéntartalma körülbelül 78,1 térfogatszázalék. Ennek a kémiai elemnek a földkéregben található szervetlen vegyületei a különböző ammóniumsók és nitrátok (sópéter). A vegyületek képlete és néhány legfontosabb anyag neve:
- NH 3, ammónia.
- NO 2, nitrogén-dioxid.
- NaNO 3, nátrium-nitrát.
- (NH 4) 2 SO 4, ammónium-szulfát.
A nitrogén vegyértéke az utolsó két vegyületben IV. A szén, a talaj és az élő szervezetek is tartalmaznak kötött formában N atomokat. A nitrogén az aminosavak, a DNS és RNS nukleotidok, a hormonok és a hemoglobin makromolekuláinak szerves része. A kémiai elem teljes tartalma az emberi szervezetben eléri a 2,5%-ot.

Egyszerű anyag
A kétatomos molekulák formájában lévő nitrogén a légköri levegő legnagyobb része térfogatban és tömegben. Az N2 képletû anyagnak nincs szaga, színe vagy íze. Ez a gáz a Föld légburokának több mint 2/3-át teszi ki. Folyékony formában a nitrogén színtelen anyag, amely vízhez hasonlít. -195,8 °C-on forr. M (N2) = 28 g/mol. Az egyszerű nitrogén anyag valamivel könnyebb, mint az oxigén, sűrűsége levegőben közel 1.
A molekulában lévő atomokat 3 közös elektronpár köti össze erősen. A vegyület nagy kémiai stabilitást mutat, ami megkülönbözteti az oxigéntől és számos más gáznemű anyagtól. Ahhoz, hogy egy nitrogénmolekula szétessen az alkotó atomokra, 942,9 kJ/mol energiát kell elkölteni. Három elektronpár kötése nagyon erős, és 2000 °C fölé melegítve bomlásnak indul.
Normál körülmények között a molekulák atomokká történő disszociációja gyakorlatilag nem történik meg. A nitrogén kémiai tehetetlensége annak is köszönhető, hogy molekulái teljesen hiányoznak a polaritásból. Nagyon gyengén lépnek kölcsönhatásba egymással, ami az anyag gáz halmazállapotáért felelős normál nyomáson és szobahőmérséklethez közeli hőmérsékleten. A molekuláris nitrogén alacsony kémiai aktivitását különféle eljárásokban és eszközökben használják fel, ahol inert környezet kialakítására van szükség.
Az N 2 -molekulák disszociációja a napsugárzás hatására a felső légkörben történhet. Atomi nitrogén képződik, amely normál körülmények között néhány fémmel és nemfémmel (foszfor, kén, arzén) reagál. Ennek eredményeképpen a földi körülmények között közvetett módon nyert anyagok szintézise zajlik.

Nitrogén vegyérték
Az atom külső elektronrétegét 2 s és 3 p elektron alkotja. A nitrogén feladhatja ezeket a negatív részecskéket, amikor más elemekkel kölcsönhatásba lép, ami megfelel redukáló tulajdonságainak. Ha az oktetthez hozzáadjuk a hiányzó 3 elektront, az atom oxidáló képességet mutat. A nitrogén elektronegativitása kisebb, nem fémes tulajdonságai kevésbé hangsúlyosak, mint a fluoroké, oxigéneké és klóroké. Amikor ezekkel a kémiai elemekkel kölcsönhatásba lép, a nitrogén elektronokat ad fel (oxidálódik). A negatív ionokká redukálást reakciók kísérik más nemfémekkel és fémekkel.
A nitrogén tipikus vegyértéke a III. Ebben az esetben kémiai kötések jönnek létre a külső p-elektronok vonzása és közös (kötő)párok létrehozása miatt. A nitrogén magányos elektronpárja révén képes donor-akceptor kötés kialakítására, ahogy az az NH 4+ ammóniumionban előfordul.
Laboratóriumban és iparban szerezték be
Az egyik laboratóriumi módszer az oxidatív tulajdonságokon alapul. Egy nitrogén és hidrogén vegyületet használnak - ammónia NH 3. Ez a bűzös gáz reakcióba lép a fekete porított réz-oxiddal. A reakció eredményeként nitrogén szabadul fel, és fémes réz (vörös por) jelenik meg. Vízcseppek, egy másik reakciótermék leülepednek a cső falán.
Egy másik laboratóriumi módszer, amely nitrogénvegyületet használ fémekkel, egy azid, például a NaN3. Az eredmény egy gáz, amelyet nem kell megtisztítani a szennyeződésektől.
A laboratóriumban az ammónium-nitrit nitrogénre és vízre bomlik. A reakció megindulásához melegítésre van szükség, majd a folyamat hőkibocsátással megy végbe (exoterm). A nitrogén szennyeződésekkel szennyezett, ezért megtisztítják és szárítják.

Nitrogén előállítása az iparban:
- a folyékony levegő frakcionált desztillációja a nitrogén és az oxigén fizikai tulajdonságait (különböző forráspontú) alkalmazó módszer;
- levegő kémiai reakciója forró szénnel;
- adszorpciós gázleválasztás.
Kölcsönhatás fémekkel és hidrogénnel - oxidáló tulajdonságok
Az erős molekulák tehetetlensége nem teszi lehetővé egyes nitrogénvegyületek közvetlen szintézissel történő előállítását. Az atomok aktiválásához az anyagot erősen fel kell melegíteni vagy be kell sugározni. A nitrogén szobahőmérsékleten reagálhat a lítiummal, de magnéziummal, kalciummal és nátriummal a reakció csak melegítéskor megy végbe. A megfelelő fémek nitridjei keletkeznek.
A nitrogén és a hidrogén kölcsönhatása magas hőmérsékleten és nyomáson megy végbe. Ehhez a folyamathoz katalizátorra is szükség van. Az eredmény az ammónia, a kémiai szintézis egyik legfontosabb terméke. A nitrogén, mint oxidálószer, vegyületeiben három negatív oxidációs állapotot mutat:
- −3 (ammónia és egyéb hidrogén-nitrogénvegyületek – nitridek);
- -2 (hidrazin N2H4);
- −1 (hidroxil-amin NH 2 OH).
A legfontosabb nitridet, az ammóniát nagy mennyiségben állítják elő az iparban. A nitrogén kémiai tehetetlensége régóta nagy probléma. Nyersanyagforrása a nitrát volt, de az ásványianyag-készletek a termelés növekedésével rohamosan csökkenni kezdtek.

A kémiai tudomány és gyakorlat nagy vívmánya volt az ammóniás módszer megalkotása a nitrogén ipari méretekben történő rögzítésére. Speciális oszlopokban közvetlen szintézist hajtanak végre - reverzibilis folyamatot a levegőből nyert nitrogén és a hidrogén között. Ha olyan optimális körülményeket alakítunk ki, amelyek a reakció egyensúlyát a termék felé tolják el, katalizátor használatával az ammónia hozama eléri a 97%-ot.
Kölcsönhatás oxigénnel - redukáló tulajdonságok
Ahhoz, hogy a nitrogén és az oxigén reakciója beinduljon, erős melegítésre van szükség. A légkörben lévő villámkisülések is elegendő energiával rendelkeznek. A legfontosabb szervetlen vegyületek, amelyekben a nitrogén pozitív oxidációs állapotában található:
- +1 (nitrogén-monoxid (I) N 2 O);
- +2 (nitrogén-monoxid NO);
- +3 (nitrogén-monoxid (III) N 2 O 3; salétromsav HNO 2, sói nitritek);
- +4 (nitrogén-dioxid (IV) NO 2);
- +5 (nitrogén-pentoxid (V) N 2 O 5, salétromsav HNO 3, nitrátok).

Jelentés a természetben
A növények ammóniumionokat és nitrát-anionokat szívnak fel a talajból, és a sejtekben folyamatosan előforduló szerves molekulák szintézisét használják fel kémiai reakciókhoz. A légköri nitrogént a gócbaktériumok – mikroszkopikus méretű lények – képesek felvenni, amelyek a hüvelyesek gyökerein növedékeket képeznek. Ennek eredményeként ez a növénycsoport megkapja a szükséges tápanyagot, és gazdagítja vele a talajt.
A trópusi esőzések során légköri nitrogénoxidációs reakciók mennek végbe. Az oxidok feloldódnak, és ezek a vízben lévő nitrogénvegyületek bejutnak a talajba. Az elem természetben való körforgása révén a földkéregben és a levegőben lévő tartalékai folyamatosan feltöltődnek. A nitrogént tartalmazó összetett szerves molekulákat a baktériumok szervetlen komponensekre bontják.

Gyakorlati használat
A mezőgazdaság legfontosabb nitrogénvegyületei a jól oldódó sók. A karbamid, kálium, kalcium), ammóniumvegyületek (ammónia vizes oldata, klorid, szulfát, ammónium-nitrát) felszívódnak a növényekben.
A nitrogén inert tulajdonságai és az, hogy a növények nem képesek felszívni a levegőből, ahhoz vezet, hogy évente nagy dózisú nitrátot kell alkalmazni. A növényi szervezet egyes részei képesek a makrotápanyagok „jövőbeli felhasználásra” tárolására, ami rontja a termék minőségét. A felesleges gyümölcs mérgezést és rosszindulatú daganatok növekedését okozhatja az emberekben. A nitrogénvegyületeket a mezőgazdaságon kívül más iparágakban is használják:
- gyógyszerek beszerzése;
- nagy molekulatömegű vegyületek kémiai szintéziséhez;
- robbanóanyagok trinitrotoluolból (TNT) történő előállítása során;
- színezékek előállítására.
A sebészetben NO oxidot használnak, az anyag fájdalomcsillapító hatású. A nitrogén kémiai tulajdonságainak első kutatói észrevették, hogy ennek a gáznak a belégzése során az érzékelés elveszett. Így jelent meg a triviális „nevetőgáz” név.

A nitrátok problémája a mezőgazdasági termékekben
A salétromsav sói – nitrátok – egyszeresen töltött NO 3-aniont tartalmaznak. Ennek az anyagcsoportnak a régi nevét, a salétromot még mindig használják. A nitrátokat szántók, üvegházak és kertek trágyázására használják. Kora tavasszal a vetés előtt, nyáron pedig folyékony műtrágyák formájában alkalmazzák. Az anyagok önmagukban nem jelentenek nagy veszélyt az emberre, de a szervezetben nitritté, majd nitrozaminokká alakulnak. A nitrit ionok NO 2- mérgező részecskék, amelyek a hemoglobin molekulákban lévő kétértékű vas oxidációját okozzák három vegyértékű ionokká. Ebben az állapotban az emberek és állatok vérének fő anyaga nem képes oxigént szállítani és szén-dioxidot eltávolítani a szövetekből.
Miért veszélyes az élelmiszerek nitrátszennyezése az emberi egészségre?
- rosszindulatú daganatok, amelyek akkor keletkeznek, amikor a nitrátokat nitrozaminokká (rákkeltő anyagokká) alakítják;
- fekélyes vastagbélgyulladás kialakulása,
- hipotenzió vagy magas vérnyomás;
- szív elégtelenség;
- vérzési zavar
- a máj, a hasnyálmirigy károsodása, a cukorbetegség kialakulása;
- veseelégtelenség kialakulása;
- vérszegénység, memóriazavar, figyelem és intelligencia.
Különböző élelmiszerek egyidejű fogyasztása nagy dózisú nitrátokkal akut mérgezéshez vezet. Források lehetnek növények, ivóvíz, kész húsételek. Tiszta vízben való áztatással és főzéssel csökkentheti az élelmiszerek nitráttartalmát. A kutatók azt találták, hogy nagyobb dózisú veszélyes vegyületek találhatók az éretlen és üvegházhatású növényi termékekben.

A foszfor a nitrogén alcsoport egyik eleme
A periódusos rendszer ugyanabban a függőleges oszlopában elhelyezkedő kémiai elemek atomjai közös tulajdonságokat mutatnak. A foszfor a harmadik periódusban található, a nitrogénhez hasonlóan a 15. csoportba tartozik. Az elemek atomszerkezete hasonló, de a tulajdonságokban vannak eltérések. A nitrogén és a foszfor negatív oxidációs állapotot és III vegyértéket mutat a fémekkel és hidrogénnel alkotott vegyületeikben.
A foszfor sok reakciója normál hőmérsékleten megy végbe, kémiailag aktív elem. Oxigénnel reagálva magasabb oxidot képez P 2 O 5 . Ennek az anyagnak a vizes oldata sav (metafoszfor) tulajdonságokkal rendelkezik. Ha melegítjük, ortofoszforsavat kapunk. Többféle sót képez, amelyek közül sok ásványi műtrágyaként szolgál, például szuperfoszfátok. A nitrogén- és foszforvegyületek fontos részét képezik bolygónkon az anyag- és energiakörforgásnak, és ipari, mezőgazdasági és egyéb tevékenységi területeken használják őket.
A cikk tartalma
NITROGÉN, N (nitrogén), kémiai elem (7. szám) Az elemek periódusos rendszerének VA alcsoportja. A Föld légköre 78 térfogatszázalék nitrogént tartalmaz. Hogy megmutassuk, milyen nagyok ezek a nitrogéntartalékok, megjegyezzük, hogy a földfelszín minden négyzetkilométere feletti légkörben annyi nitrogén található, hogy akár 50 millió tonna nátrium-nitrát vagy 10 millió tonna ammónia (a nitrogén vegyülete hidrogén) nyerhető belőle, de ez a földkéregben található nitrogén kis hányadát teszi ki. A szabad nitrogén jelenléte jelzi annak tehetetlenségét és azt, hogy nehéz kölcsönhatásba lépni más elemekkel normál hőmérsékleten. A rögzített nitrogén szerves és szervetlen anyagok része is. A növényi és állati élet szénhez kötött nitrogént és oxigént tartalmaz a fehérjékben. Ezen kívül ismertek és előállíthatók nitrogéntartalmú szervetlen vegyületek, mint a nitrátok (NO 3 –), nitritek (NO 2 –), cianidok (CN –), nitridek (N 3 –) és azidok (N 3 –). Nagy mennyiségű ).
Történelmi hivatkozás.
A. Lavoisier kísérletei, amelyek a légkör életfenntartó és égési folyamatok fenntartásában betöltött szerepének tanulmányozásával foglalkoztak, megerősítették egy viszonylag inert anyag létezését a légkörben. Anélkül, hogy megállapította volna az égés után visszamaradt gáz elemi természetét, Lavoisier azotának nevezte el, ami az ógörögül „élettelent” jelent. 1772-ben D. Rutherford Edinburghból megállapította, hogy ez a gáz egy elem, és „káros levegőnek” nevezte. A nitrogén latin neve a görög nitron és szavakból származik gen, ami "sópéterképzőt" jelent.
A nitrogén rögzítése és a nitrogén körforgása.
A "nitrogénkötés" kifejezés a légköri nitrogén N 2 megkötésének folyamatára vonatkozik. A természetben ez kétféleképpen történhet: vagy a hüvelyesek, például a borsó, a lóhere és a szójabab, csomókat halmoznak fel a gyökereiken, amelyekben a nitrogénmegkötő baktériumok nitráttá alakítják, vagy a légköri nitrogént villámlás közben oxigén oxidálja. S. Arrhenius megállapította, hogy évente akár 400 millió tonna nitrogént rögzítenek így. A légkörben a nitrogén-oxidok az esővízzel egyesülve salétromsav és salétromsav keletkezik. Emellett megállapították, hogy esővel és hóval kb. 6700 g nitrogén; a talajba érve nitritté és nitráttá alakulnak. A növények nitrátokat használnak növényi fehérjék képzésére. Az ezekkel a növényekkel táplálkozó állatok a növények fehérjeanyagait asszimilálják és állati fehérjékké alakítják át. Az állatok és növények elpusztulása után lebomlanak, és a nitrogénvegyületek ammóniává alakulnak. Az ammóniát kétféleképpen hasznosítják: a nitrátokat nem képző baktériumok elemivé bontják, nitrogént és hidrogént szabadítanak fel, más baktériumok pedig nitriteket képeznek belőle, amelyeket más baktériumok nitráttá oxidálnak. Így megy végbe a természetben a nitrogénkör, vagy a nitrogénkör.
Az atommag és az elektronhéj szerkezete.
A természetben a nitrogénnek két stabil izotópja létezik: 14 tömegszámú (7 protont és 7 neutront tartalmaz) és 15 tömegszámú (7 protont és 8 neutront tartalmaz). Arányuk 99,635:0,365, tehát a nitrogén atomtömege 14,008. Az instabil 12 N, 13 N, 16 N, 17 N nitrogén izotópokat mesterségesen kaptuk. Sematikusan a nitrogénatom elektronszerkezete a következő: 1 s 2 2s 2 2p x 1 2p y 1 2p z 1 . Következésképpen a külső (második) elektronhéj 5 elektront tartalmaz, amelyek részt vehetnek a kémiai kötések kialakításában; a nitrogénpályák elektronokat is tudnak fogadni, pl. (–III)-tól (V)-ig oxidációs állapotú vegyületek képződése lehetséges, ezek ismertek.
Molekuláris nitrogén.
A gázsűrűség meghatározásából kiderült, hogy a nitrogénmolekula kétatomos, azaz. a nitrogén molekulaképlete Nє N (vagy N 2). Két nitrogénatom három külső 2-vel rendelkezik p-az egyes atomok elektronjai hármas kötést alkotnak:N:::N:, elektronpárokat alkotva. A mért N–N atomközi távolság 1,095 Å. Mint a hidrogén esetében ( cm. HIDROGÉN), léteznek nitrogénmolekulák különböző nukleáris spinekkel - szimmetrikus és antiszimmetrikus. Normál hőmérsékleten a szimmetrikus és antiszimmetrikus formák aránya 2:1. Szilárd állapotban a nitrogénnek két módosulása ismert: a– köbös és b– hatszögletű, átmeneti hőmérséklettel a ® b–237,39° C. Módosítás b olvad –209,96°C-on, forráspontja –195,78°C 1 atm nyomáson ( cm. asztal 1).
Egy mól (28,016 g vagy 6,023 H 10 23 molekula) molekuláris nitrogén atomokra (N 2 2N) történő disszociációs energiája körülbelül –225 kcal. Ezért atomi nitrogén képződhet csendes elektromos kisülés során, és kémiailag aktívabb, mint a molekuláris nitrogén.
Átvétel és jelentkezés.
Az elemi nitrogén előállításának módja a kívánt tisztaságtól függ. A nitrogén nagy mennyiségben nyerhető az ammónia szintéziséhez, míg a nemesgázok kis keverékei elfogadhatók.
Nitrogén a légkörből.
Gazdasági szempontból a nitrogén légkörből való felszabadulása a tisztított levegő cseppfolyósítási módszerének alacsony költségének köszönhető (eltávolítják a vízgőzt, a CO 2 -t, a port és egyéb szennyeződéseket). Az ilyen levegő egymást követő kompressziós, hűtési és expanziós ciklusai annak cseppfolyósodásához vezetnek. A folyékony levegőt frakcionált desztillációnak vetik alá, lassú hőmérséklet-emelkedéssel. Először a nemesgázok szabadulnak fel, majd a nitrogén, és folyékony oxigén marad. A tisztítást ismételt frakcionálási eljárásokkal érik el. Ezzel a módszerrel évente sok millió tonna nitrogént állítanak elő, főként az ammónia szintézisére, amely az ipar és a mezőgazdaság számára a különböző nitrogéntartalmú vegyületek előállítási technológiájának alapanyaga. Ezenkívül gyakran használnak tisztított nitrogénatmoszférát, ha az oxigén jelenléte elfogadhatatlan.
Laboratóriumi módszerek.
A nitrogént kis mennyiségben a laboratóriumban különféle módokon nyerhetjük ammónia vagy ammóniumion oxidálásával, pl.
Az ammóniumion nitritionnal történő oxidációja nagyon kényelmes:
Más módszerek is ismertek - azidok bomlása hevítéskor, ammónia lebontása réz(II)-oxiddal, nitritek kölcsönhatása szulfaminsavval vagy karbamiddal:
Az ammónia katalitikus bomlása magas hőmérsékleten nitrogént is termelhet:
Fizikai tulajdonságok.
A nitrogén néhány fizikai tulajdonságát a táblázat tartalmazza. 1.
| 1. táblázat A NITROGÉN NÉHÁNY FIZIKAI TULAJDONSÁGA | |
| Sűrűség, g/cm3 | 0,808 (folyékony) |
| Olvadáspont, °C | –209,96 |
| Forráspont, °C | –195,8 |
| Kritikus hőmérséklet, °C | –147,1 |
| Kritikus nyomás, atm a | 33,5 |
| Kritikus sűrűség, g/cm 3 a | 0,311 |
| Fajlagos hőkapacitás, J/(molCH) | 14,56 (15°C) |
| Elektronegativitás Pauling szerint | 3 |
| kovalens sugár, | 0,74 |
| kristály sugár, | 1,4 (M 3–) |
| Ionizációs potenciál, V b | |
| első | 14,54 |
| második | 29,60 |
| a Hőmérséklet és nyomás, amelyen a folyékony és a gáznemű nitrogén sűrűsége azonos. b Az első külső és az azt követő elektronok eltávolításához szükséges energia mennyisége 1 mól atomi nitrogénre vonatkoztatva. |
|
Kémiai tulajdonságok.
Mint már említettük, a nitrogén domináns tulajdonsága normál hőmérsékleti és nyomási körülmények között a tehetetlensége vagy alacsony kémiai aktivitása. A nitrogén elektronszerkezete egy 2-es elektronpárt tartalmaz s-szint és három félig töltött 2 R-pályák, tehát egy nitrogénatom legfeljebb négy másik atomot tud megkötni, azaz. koordinációs száma négy. Egy atom kis mérete korlátozza a hozzá társítható atomok vagy atomcsoportok számát is. Ezért a VA alcsoport más tagjainak számos vegyülete vagy nem rendelkezik analógokkal a nitrogénvegyületek között, vagy a hasonló nitrogénvegyületek instabilnak bizonyulnak. Tehát a PCl 5 stabil vegyület, de az NCl 5 nem létezik. Egy nitrogénatom képes egy másik nitrogénatomhoz kapcsolódni, így több meglehetősen stabil vegyületet képez, mint például a hidrazin N 2 H 4 és az MN 3 fémazidok. Ez a fajta kötés szokatlan a kémiai elemeknél (a szén és a szilícium kivételével). Magasabb hőmérsékleten a nitrogén sok fémmel reagál, részben ionos nitrideket képezve M. x N y. Ezekben a vegyületekben a nitrogén negatív töltésű. táblázatban A 2. táblázat az oxidációs állapotokat és a megfelelő vegyületek példáit mutatja be.
Nitridok.
A több elektropozitív elemet, fémeket és nemfémeket tartalmazó nitrogénvegyületek - nitridek - hasonlóak a karbidokhoz és hidridekhez. Az M–N kötés természetétől függően ionos, kovalens és köztes típusú kötésekre oszthatók. Általában ezek kristályos anyagok.
Ionos nitridek.
Ezekben a vegyületekben a kötés magában foglalja az elektronok átvitelét a fémből a nitrogénbe, és így N3-ion keletkezik. Ilyen nitridek a Li 3 N, Mg 3 N 2, Zn 3 N 2 és Cu 3 N 2. A lítiumon kívül más alkálifémek nem képezik a nitridek IA alcsoportját. Az ionos nitridek magas olvadáspontúak, és vízzel reagálva NH 3 -t és fémhidroxidot képeznek.
Kovalens nitridek.
Amikor a nitrogénelektronok egy másik elem elektronjaival együtt vesznek részt egy kötés kialakításában anélkül, hogy a nitrogénből egy másik atomba átkerülnének, kovalens kötéssel rendelkező nitridek képződnek. A hidrogén-nitridek (például az ammónia és a hidrazin) teljesen kovalensek, akárcsak a nitrogén-halogenidek (NF 3 és NCl 3). A kovalens nitridek közé tartoznak például a Si 3 N 4, P 3 N 5 és a BN - rendkívül stabil fehér anyagok, és a BN-nek két allotróp módosulata van: hatszögletű és gyémántszerű. Ez utóbbi nagy nyomáson és hőmérsékleten jön létre, és keménysége közel áll a gyémánt keménységéhez.
Nitridek köztes típusú kötéssel.
Az átmeneti elemek magas hőmérsékleten reagálnak az NH 3-mal, és szokatlan vegyületcsoportot képeznek, amelyben a nitrogénatomok szabályosan elhelyezkedő fématomok között oszlanak meg. Ezekben a vegyületekben nincs egyértelmű elektroneltolódás. Ilyen nitridek például a Fe 4 N, W 2 N, Mo 2 N, Mn 3 N 2. Ezek a vegyületek általában teljesen inertek és jó elektromos vezetőképességgel rendelkeznek.
A nitrogén hidrogénvegyületei.
A nitrogén és a hidrogén reakcióba lépve olyan vegyületeket képeznek, amelyek homályosan hasonlítanak a szénhidrogénekre. A hidrogén-nitrátok stabilitása csökken a nitrogénatomok számának növekedésével a láncban, ellentétben a szénhidrogénekkel, amelyek hosszú láncokban stabilak. A legfontosabb hidrogén-nitridek az ammónia NH 3 és a hidrazin N 2 H 4. Ide tartozik a HNNN (HN 3) sósav is.
Ammónia NH3.
Az ammónia a modern gazdaság egyik legfontosabb ipari terméke. A 20. század végén. Az USA-ban kb. 13 millió tonna ammónia évente (vízmentes ammóniára vonatkoztatva).
Molekula szerkezete.
Az NH 3 molekula szinte piramis alakú. A H–N–H kötésszög 107°, ami közel áll a 109°-os tetraéderszöghez. A magányos elektronpár ekvivalens a kapcsolódó csoporttal, ami azt eredményezi, hogy a nitrogén koordinációs száma 4, a nitrogén pedig a tetraéder közepén helyezkedik el.
Az ammónia tulajdonságai.
Az ammónia néhány fizikai tulajdonságát a vízzel összehasonlítva a táblázat tartalmazza. 3.
Az ammónia forrás- és olvadáspontja sokkal alacsonyabb, mint a vízé, annak ellenére, hogy a molekulatömegek és a molekulaszerkezet hasonlóak. Ez azzal magyarázható, hogy a vízben az intermolekuláris kötések viszonylag erősebbek, mint az ammóniában (az ilyen intermolekuláris kötéseket hidrogénkötéseknek nevezzük).
Oldószerként ammónia.
A folyékony ammónia nagy dielektromos állandója és dipólusmomentuma lehetővé teszi poláris vagy ionos szervetlen anyagok oldószereként való alkalmazását. Az ammónia oldószer köztes helyet foglal el a víz és a szerves oldószerek, például az etil-alkohol között. Az alkáli- és alkáliföldfémek ammóniában oldódnak, sötétkék oldatokat képezve. Feltételezhető, hogy a vegyértékelektronok szolvatációja és ionizációja oldatban történik a séma szerint
A kék szín a szolvatációval és az elektronok mozgásával vagy a folyadékban lévő „lyukak” mozgásával kapcsolatos. A folyékony ammóniában lévő nátrium magas koncentrációja esetén az oldat bronz színt vesz fel, és elektromosan erősen vezetőképes. A kötetlen alkálifém az ilyen oldatból ammónia lepárlásával vagy nátrium-klorid hozzáadásával választható el. A fémek ammóniában készült oldatai jó redukálószerek. Az autoionizáció folyékony ammóniában megy végbe
hasonló a vízben végbemenő folyamathoz:
Mindkét rendszer kémiai tulajdonságait a táblázatban hasonlítjuk össze. 4.
A folyékony ammónia mint oldószer előnyt jelent bizonyos esetekben, amikor a komponensek vízzel való gyors kölcsönhatása miatt (például oxidáció és redukció) nem lehetséges vízben reakciókat végrehajtani. Például a folyékony ammóniában a kalcium reakcióba lép a KCl-dal, CaCl 2-t és K-t képezve, mivel a CaCl2 nem oldódik folyékony ammóniában, a K pedig oldódik, és a reakció teljesen lezajlik. Vízben egy ilyen reakció lehetetlen a Ca és a víz gyors kölcsönhatása miatt.
Ammónia előállítása.
Az ammóniumsókból erős bázis, például NaOH hatására gáznemű NH 3 szabadul fel:
A módszer laboratóriumi körülmények között alkalmazható. A kisüzemi ammóniatermelés is nitridek, például Mg 3 N 2 vízzel való hidrolízisén alapul. A kalcium-cianamid CaCN 2 vízzel kölcsönhatásba lépve ammóniát is képez. Az ammónia előállításának fő ipari módszere a légköri nitrogénből és hidrogénből magas hőmérsékleten és nyomáson történő katalitikus szintézis:
Ehhez a szintézishez a hidrogént szénhidrogének termikus krakkolása, vízgőz szénre vagy vasra gyakorolt hatására, alkoholok vízgőzzel történő lebontásával vagy víz elektrolízisével nyerik. Számos szabadalom érkezett az ammónia szintézisére, amelyek az eljárás körülményei között (hőmérséklet, nyomás, katalizátor) különböznek. Létezik egy ipari termelési módszer a szén termikus desztillációjával. F. Haber és K. Bosch nevéhez fűződik az ammóniaszintézis technológiai fejlődése.
| 4. táblázat: A VÍZ- ÉS AMMÓNIÁS KÖRNYEZETBEN A REAKCIÓK ÖSSZEHASONLÍTÁSA | |
| Vízi környezet | Ammónia környezet |
| Semlegesítés | |
| OH – + H 3 O + ® 2H 2 O | NH 2 – + NH 4 + ® 2NH 3 |
| Hidrolízis (protolízis) | |
| PCl 5 + 3H 2 O POCl 3 + 2H 3 O + + 2Cl – | PCl 5 + 4NH 3 PNCl 2 + 3NH 4 + + 3Cl – |
| Helyettesítés | |
| Zn + 2H 3 O + ® Zn 2+ + 2H 2 O + H 2 | Zn + 2NH4 + ® Zn 2+ + 2NH3 + H 2 |
| Megoldás (komplexitás) | |
| Al 2 Cl 6 + 12H 2 O 2 3+ + 6Cl – | Al 2 Cl 6 + 12NH 3 2 3+ + 6Cl – |
| Amfoteritás | |
| Zn 2+ + 2OH – Zn(OH) 2 | Zn 2+ + 2NH 2 – Zn(NH 2) 2 |
| Zn(OH)2 + 2H3O + Zn2+ + 4H2O | Zn(NH 2) 2 + 2NH 4 + Zn 2+ + 4NH 3 |
| Zn(OH) 2 + 2OH – Zn(OH) 4 2– | Zn(NH 2) 2 + 2NH 2 – Zn(NH 2) 4 2– |
Az ammónia kémiai tulajdonságai.
A táblázatban említett reakciókon kívül. 4, az ammónia vízzel reagálva NH 3 N H 2 O vegyületet képez, amelyet gyakran tévesen NH 4 OH ammónium-hidroxidnak tekintenek; valójában az NH 4 OH létezése oldatban nem bizonyított. Az ammónia vizes oldata ("ammónia") túlnyomórészt NH 3 -ból, H 2 O-ból és kis koncentrációjú NH 4 + és OH - ionokból áll, amelyek a disszociáció során keletkeznek.
Az ammónia alapvető természetét a nitrogén:NH 3 magányos elektronpár jelenléte magyarázza. Ezért az NH 3 egy Lewis-bázis, amely a legmagasabb nukleofil aktivitással rendelkezik, amely protonnal vagy hidrogénatom magjával való asszociáció formájában nyilvánul meg:
Bármely ion vagy molekula, amely képes elfogadni egy elektronpárt (elektrofil vegyület), reakcióba lép az NH 3-mal, és koordinációs vegyületet képez. Például:
M szimbólum n A + egy átmeneti fémiont jelöl (a periódusos rendszer B-alcsoportja, pl. Cu 2+, Mn 2+ stb.). Bármely protikus (azaz H-tartalmú) sav reagál ammóniával vizes oldatban, és ammóniumsókat képez, mint például ammónium-nitrát NH 4 NO 3, ammónium-klorid NH 4 Cl, ammónium-szulfát (NH 4) 2 SO 4, foszfát-ammónium 4) 3 PO 4. Ezeket a sókat széles körben használják a mezőgazdaságban műtrágyaként a nitrogén talajba juttatására. Az ammónium-nitrátot olcsó robbanóanyagként is használják; először kőolajjal (dízelolajjal) használták. Az ammónia vizes oldatát közvetlenül a talajba vagy öntözővízzel történő bejuttatásra használják. Az ammóniából és szén-dioxidból szintézissel nyert karbamid NH 2 CONH 2 szintén műtrágya. Az ammóniagáz reakcióba lép fémekkel, például nátriummal és káliummal amidokat képezve:
Az ammónia hidridekkel és nitridekkel is amidokat képez:
Az alkálifém-amidok (például NaNH 2) hevítés közben reagálnak N 2 O-val, és azidokat képeznek:
A gáznemű NH 3 magas hőmérsékleten fémekké redukálja a nehézfém-oxidokat, nyilvánvalóan az ammónia N 2 -vé és H 2 -vé bomlásakor keletkező hidrogén miatt:
Az NH 3 molekulában a hidrogénatomok helyettesíthetők halogénnel. A jód tömény NH 3 oldattal reagál, NI 3 tartalmú anyagok keverékét képezve. Ez az anyag nagyon instabil, és a legkisebb mechanikai behatásra is felrobban. Amikor az NH 3 reagál Cl 2-vel, NCl 3, NHCl 2 és NH 2 Cl klóraminok keletkeznek. Ha az ammóniát nátrium-hipoklorit NaOCl hatásának teszik ki (NaOH-ból és Cl 2 -ből képződik), a végtermék hidrazin:
Hidrazin.
A fenti reakciók N 2 H 4 P H 2 O összetételű hidrazin-monohidrát előállításának módszerei. A vízmentes hidrazint a monohidrát speciális desztillációjával BaO-val vagy más vízeltávolító anyagokkal állítják elő. A hidrazin tulajdonságai kissé hasonlóak a H 2 O 2 hidrogén-peroxidéhoz. A tiszta vízmentes hidrazin színtelen, higroszkópos folyadék, forráspontja 113,5 °C; jól oldódik vízben, gyenge bázist képezve
Savas környezetben (H +) a hidrazin + X – típusú oldható hidrazóniumsókat képez. A hidrazin és egyes származékai (például a metil-hidrazin) oxigénnel való reakciójának könnyedsége lehetővé teszi, hogy folyékony rakéta-üzemanyagként használják fel. A hidrazin és származékai erősen mérgezőek.
Nitrogén-oxidok.
Az oxigénnel rendelkező vegyületekben a nitrogén minden oxidációs állapotot mutat, és oxidokat képez: N 2 O, NO, N 2 O 3, NO 2 (N 2 O 4), N 2 O 5. A nitrogén-peroxidok (NO 3, NO 4) képződéséről kevés információ áll rendelkezésre. 2HNO2. A tiszta N 2 O 3 kék folyadék formájában nyerhető alacsony hőmérsékleten (-20
Szobahőmérsékleten az NO 2 egy sötétbarna gáz, amelynek mágneses tulajdonságai vannak a párosítatlan elektron jelenléte miatt. 0°C alatti hőmérsékleten az NO 2 molekula dinitrogén-tetroxiddá dimerizálódik, és –9,3°C-on teljes a dimerizáció: 2NO 2 N 2 O 4. Folyékony állapotban csak 1% NO 2 dimerizálatlan, és 100°C-on 10% N 2 O 4 marad dimer formájában.
A NO 2 (vagy N 2 O 4) meleg vízben reagál salétromsavat képezve: 3NO 2 + H 2 O = 2HNO 3 + NO. A NO 2 technológia ezért nagyon fontos egy iparilag fontos termék – a salétromsav – előállításának közbenső szakaszaként.
Nitrogén-monoxid (V)
N2O5( elavult. salétromsavanhidrid) egy fehér kristályos anyag, amelyet salétromsav dehidratálásával nyernek foszfor-oxid P 4 O 10 jelenlétében:
2MX + H 2 N 2 O 2. Az oldat elpárologtatása után fehér robbanóanyag keletkezik, amelynek szerkezete H–O–N=N–O–H.Salétromsav
A HNO 2 tiszta formában nem létezik, azonban kis koncentrációjú vizes oldatok keletkeznek úgy, hogy a bárium-nitrithez kénsavat adnak:
Salétromsav keletkezik akkor is, ha NO és NO 2 (vagy N 2 O 3) ekvimoláris keverékét vízben oldjuk. A salétromsav valamivel erősebb, mint az ecetsav. A benne lévő nitrogén oxidációs állapota +3 (szerkezete H–O–N=O), i.e. lehet oxidálószer és redukálószer is. Redukálószerek hatására általában NO-vá redukálódik, oxidálószerekkel kölcsönhatásba lépve pedig salétromsavvá oxidálódik.
Egyes anyagok, például fémek vagy jodidionok salétromsavban való oldódási sebessége a szennyeződésként jelenlévő salétromsav koncentrációjától függ. A salétromsav sói - nitritek - jól oldódnak vízben, kivéve az ezüst-nitrit. A NaNO 2-t festékek előállításához használják.
Salétromsav
A HNO 3 a fő vegyipar egyik legfontosabb szervetlen terméke. Számos más szervetlen és szerves anyag technológiájában használják, mint például robbanóanyagok, műtrágyák, polimerek és szálak, színezékek, gyógyszerek stb.
Irodalom:
Nitrogenist's Directory. M., 1969
Nekrasov B.V. Az általános kémia alapjai. M., 1973
Nitrogén rögzítési problémák. Szervetlen és fizikai kémia. M., 1982