A propán alacsony toxikus kibocsátással ég. Lehetőség van kalcium-hidroxidot ipari méretekben előállítani kalcium-oxid vízzel való összekeverésével, ezt az eljárást oltásnak nevezik.
VPR. Kémia. 11. évfolyam kód
11. OSZTÁLY Magyarázatok az összorosz tesztmunka mintájához A minta tesztmunka megismerésekor ne feledje, hogy a mintában szereplő feladatok nem tükrözik mindazokat a készségeket és tartalmi kérdéseket, amelyeket a teszt részeként tesztelünk. az összoroszországi tesztmunka. A munkában tesztelhető tartalmi elemek és készségek teljes listája a tartalmi elemek és a diplomások képzési szintjére vonatkozó követelmények kodifikátorában található egy teljes orosz kémia teszt kidolgozásához. A minta tesztmunka célja, hogy képet adjon az összoroszországi tesztmunka felépítéséről, a feladatok számáról és formájáról, valamint azok összetettségi szintjéről.
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata ÖSSZOROSZ MUNKAVÉMIAI VIZSGÁLAT
11. OSZTÁLY MINTA Útmutató a munka elvégzéséhez A tesztmunka 15 feladatot tartalmaz. A kémia munka elvégzésére 1 óra 30 perc áll rendelkezésre. Írja be a válaszokat a feladatokhoz tartozó utasítások szerint, ha hibás választ ír le, és írjon újat! mellette a munka elvégzésekor az alábbi kiegészítő anyagokat használhatja
– Kémiai elemek periódusos rendszere D.I. Mengyelejev
– a sók, savak és bázisok oldhatósági táblázata, amely bevezeti a fémfeszültségek elektrokémiai sorozatát
– nem programozható számológép. A feladatok elkészítésekor használhat vázlatot. A tervezetben szereplő bejegyzéseket nem vizsgáljuk felül és nem értékeljük. Javasoljuk, hogy a feladatokat a megadott sorrendben végezze el. Időmegtakarítás érdekében hagyjon ki egy olyan feladatot, amelyet nem tud azonnal végrehajtani, és lépjen a következőre. Ha az összes munka elvégzése után marad ideje, visszatérhet az elmulasztott feladatokhoz. Az elvégzett feladatokért kapott pontok összegzésre kerülnek. Próbálj meg minél több feladatot teljesíteni, és szerezd meg a legtöbb pontot. Sok sikert kívánunk
VPR. Kémia. 11. évfolyam kód
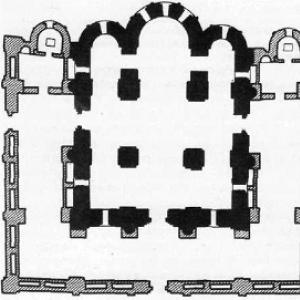
© 2017 Az Orosz Föderáció Oktatási és Tudományos Szövetségi Felügyeleti Szolgálata A kémia kurzusából a következő módszereket ismeri a keverékek szétválasztására: ülepítés, szűrés, desztilláció (desztilláció, mágneses hatás, párolgás, kristályosítás. Az 1–3. néhány ilyen módszer alkalmazása 1. ábra 3. ábra
Az alábbi keverékek elválasztási módszerei közül melyik használható a tisztításhoz?
1) beszorult vasreszelékből származó liszt
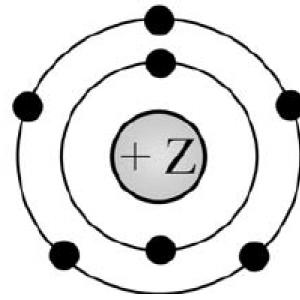
2) a benne oldott szervetlen sókból származó víz Írja be a táblázatba az ábra számát és a megfelelő elválasztási módszer nevét! Keverék ábra szám A keverék szétválasztásának módja Liszt és beszorult vasreszelék Víz, benne oldott szervetlen sók Az ábrán egy bizonyos kémiai elem atomjának elektronszerkezetének modellje látható. A javasolt modell elemzése alapján végezze el az alábbi feladatokat) határozza meg azt a kémiai elemet, amelynek atomja ilyen elektronszerkezettel rendelkezik!
2) tüntesse fel a periódusszámot és a csoportszámot a kémiai elemek periódusos rendszerében D.I. Mengyelejev, amelyben ez az elem található
3) határozza meg, hogy az egyszerű anyag, amely ezt a kémiai elemet képezi, fém vagy nem fém. Válaszait írja be a táblázatba! Válasz Vegyi elem szimbólum
számú időszak
Csoportszám Fém nemfém
1
2
VPR. Kémia. 11. évfolyam kód
© 2017 Szövetségi Oktatási és Tudományos Felügyeleti Szolgálat az Orosz Föderáció Kémiai elemek periódusos rendszere D.I. Mengyelejev gazdag információs tárháza a kémiai elemekről, tulajdonságaikról és vegyületeik tulajdonságairól, ezen tulajdonságok változásának mintázatairól, az anyagok kinyerésének módszereiről és a természetben való elhelyezkedésükről. Például ismert, hogy egy kémiai elem rendszámának periódusonkénti növekedésével az atomok sugara csökken, csoportokban pedig nő. Ezeket a törvényszerűségeket figyelembe véve rendezze a következő elemeket növekvő atomsugár sorrendbe: N, C, Al, Si. Írja le az elemek megnevezését a kívánt sorrendben! Válasz _________________________________ Az alábbi táblázat a molekuláris és ionos szerkezetű anyagok jellemző tulajdonságait sorolja fel. Az anyagok jellemző tulajdonságai Molekulaszerkezet Ionos szerkezet normál körülmények között folyékony, gáz- és szilárd halmazállapotúak aggregációjuk alacsony forrás- és olvadáspontjuk
nem vezető; alacsony hővezető képességgel rendelkeznek
normál körülmények között szilárd, törékeny, tűzálló, olvadékokban és oldatokban nem illékony, elektromos áramot vezet. Válaszát írja be a kijelölt helyre.
1) nitrogén N
2
________________________________________________________________
2) konyhasó NaCl ________________________________________________________
3
4
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata Az összetett szervetlen anyagok feltételesen eloszthatók, azaz négy csoportba sorolhatók, amint az az ábrán látható. Ezen a diagramon mind a négy csoporthoz töltse ki az anyagok hiányzó csoportneveit vagy kémiai képleteit (egy példa az ebbe a csoportba tartozó képletekre. Olvassa el az alábbi szöveget, és töltse ki a 6–8. feladatokat. Az élelmiszeripar E élelmiszer-adalékanyagot használ, ami kalcium-hidroxid Ca(OH)
2
. Gyümölcslevek, bébiételek, ecetes uborka, konyhasó, édességek és édességek előállításához használják. A kalcium-hidroxid ipari méretekben is előállítható kalcium-oxid vízzel való összekeverésével, ezt a folyamatot kioltásnak nevezik. A kalcium-hidroxidot széles körben használják építőanyagok, például mész-, vakolat- és gipszhabarcsok gyártásában. Ez annak köszönhető, hogy képes kölcsönhatásba lépni a szén-dioxiddal
2
tartalmazza a levegő. A kalcium-hidroxid-oldat ugyanazt a tulajdonságát használják a levegő szén-dioxid-tartalmának mérésére. A kalcium-hidroxid hasznos tulajdonsága, hogy flokkulálószerként képes megtisztítani a szennyvizet a szuszpendált és kolloid részecskéktől (beleértve a vassókat is. A víz pH-értékének növelésére is használják, mivel a természetes víz olyan anyagokat tartalmaz (például savakat, amelyek a szennyeződést okozzák). korrózió a vízvezeték-szerelvényekben).
5
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata
6 1. Írja fel a szövegben említett kalcium-hidroxid keletkezési reakciójának molekulaegyenletét! Válasz
2. Magyarázza meg, miért hívják ezt a folyamatot kioltásnak! Válasz
________________________________________________________________________________
1. Írja fel a szövegben említett kalcium-hidroxid és szén-dioxid reakciójának molekuláris egyenletét! Válasz
2. Magyarázza el, hogy ennek a reakciónak milyen jellemzői teszik lehetővé a levegőben lévő szén-dioxid kimutatására. Válasz
________________________________________________________________________________
________________________________________________________________________________
1. Írjon fel egy rövidített ionegyenletet a szövegben említett kalcium-hidroxid és sósav reakciójára! Válasz
2. Magyarázza meg, miért használják ezt a reakciót a víz pH-értékének növelésére! Válasz
________________________________________________________________________________
________________________________________________________________________________
6
7
8
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata A redox reakció sémája látható.
H
2
S + Fe
2
O
3
→ FeS + S + H
2
O
1. Készítsen elektronikus mérleget ehhez a reakcióhoz. Válasz
2. Azonosítsa az oxidálószert és a redukálószert. Válasz
3. Rendezd el az együtthatókat a reakcióegyenletben! Válasz A transzformációs séma adott
Fe Írja fel azokat a molekuláris reakcióegyenleteket, amelyek segítségével elvégezheti a jelzett transzformációkat!
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _______________________________________________________________________________ Állítsa be a megfelelést egy szerves anyag képlete és az osztály/csoport között, amelybe az anyag tartozik minden egyes betűvel jelölt pozícióba, válassza ki a megfelelő számmal jelölt pozíciót. AZ ANYAG KÉPLETE
OSZTÁLY/CSOPORT A)
CH
3
-CH
2
-CH
3
IDŐSZÁMÍTÁSUNK ELŐTT)
CH
3
-CH
2
Ó
1) telített szénhidrogének
2) alkoholok
3) telítetlen szénhidrogének
4) karbonsavak A kiválasztott számokat írja be a táblázatba a megfelelő betűk alá! A B C Válasz
9
10
11
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata Illessze be a hiányzó anyagok képleteit a javasolt kémiai reakciósémákba, és rendezze az együtthatókat.
1) C
2
N
6
+ ……………… → C
2
N
5
Cl+HCl
2) C
3
H
6
+ ……………… → CO
2
+H
2
O A propán alacsony mérgező kibocsátással ég a légkörbe, ezért számos alkalmazásban energiaforrásként használják, például gázgyújtóknál és lakásfűtésnél. Mekkora térfogatú szén-dioxid keletkezik 4,4 g propán teljes elégetésekor. Írja le a probléma részletes megoldását! Válasz
________________________________________________________________________________
______________________________________________________________________________ Az izopropil-alkoholt univerzális oldószerként használják háztartási vegyszerekben, parfümökben és kozmetikumokban, valamint az autók szélvédőmosó folyadékaiban. Az alábbi diagramnak megfelelően hozzon létre reakcióegyenleteket ennek az alkoholnak a előállításához. A reakcióegyenletek felírásakor használja a szerves anyagok szerkezeti képleteit.
CH
2
CH CH
3
CH
3
CCH
3
O
CH
3
CH CH
3
Br
CH
3
CH
CH
3
Ó
1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
12
13
14
VPR. Kémia. 11. évfolyam kód
© 2017 Az Orosz Föderáció Oktatási és Tudományos Szövetségi Felügyeleti Szolgálata A sóoldat az orvostudományban 0,9%-os vizes nátrium-klorid-oldat. Számítsa ki az elkészítéshez szükséges nátrium-klorid és víz tömegét!
500 g sóoldat. Írjon részletes megoldást a problémára. Válasz
________________________________________________________________________________
________________________________________________________________________________
15
VLOOKUP
. Kémia. 11. évfolyam. Válaszok 2017. évi Szövetségi Oktatási és Tudományos Felügyeleti Szolgálat az Orosz Föderáció ÖSSZOROSSZORSZÁGI ELLENŐRZÉSI MUNKÁJA
KÉMIA
, 11
OSZTÁLY
Válasz
ety
és értékelési kritériumok
ania
№
feladatokat
Válasz
nem
1
Keverék
Szám
rajz
Út
elválasztás
keverékek
Liszt és beszorult vasreszelék Mágneses hatás
Víz, benne oldott szervetlen sók
Lepárlás
(lepárlás
2
N; 2; 5 (vagy V); nem fém N
→
C
→
Si
→
Al
4 nitrogén N
2
– konyhasó NaCl molekulaszerkezete – ionos szerkezet 132 A 3. feladat helyes válasza egy pontot ér
Az 1., 2., 4., 11. feladatok teljesítését a következőképpen értékelik: 2 pont - nincs hiba
1 pont – egy hiba 0 pont – kettő vagy több hiba történt, vagy nem érkezett válasz
Tartalom
helyes válasz és instrukciók az értékeléshez
n
Iyu
Pontok
Válaszelemek A bázis- és sócsoportok nevét felírjuk, a megfelelő csoportok anyagainak képleteit felírjuk.
A válasz helyes és teljes, tartalmazza a séma három celláját helyesen.
5
VLOOKUP
. Kémia. 11. évfolyam. Válaszok 2017. Az Orosz Föderáció Oktatási és Tudományos Szövetségi Felügyeleti Szolgálata A helyes válasz tartalma és az értékelési utasítások
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
Válaszelemek
1) CaO + H
2
O = Ca(
Ó)
2 2) Amikor a kalcium-oxid kölcsönhatásba lép a vízzel, nagy mennyiségű hő szabadul fel, így a víz felforr és sziszeg, mintha forró szenet érne, amikor a tüzet vízzel eloltják (
vagy
„Ezt a folyamatot oltásnak nevezik, mert ennek eredményeként oltott mész képződik
»)
A válasz helyes és teljes, tartalmazza az összes fenti elemet A válasz tartalmazza a fenti elemek egyikét 1 A válasz minden eleme rosszul van megírva 0 Maximális pontszám 2 A helyes válasz tartalma és a pontozási utasítások
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
Válaszelemek
1) Ca(OH)
2
+ CO
2
= CaCO
3
↓+H
2
O
2) Ennek a reakciónak a hatására oldhatatlan anyag, kalcium-karbonát keletkezik, az eredeti oldat zavarossága figyelhető meg, ami lehetővé teszi a szén-dioxid jelenlétének megítélését a levegőben A kvalitatív reakció A válasz helyes és teljes, tartalmazza az összes fenti elemet A válasz tartalmazza a fenti elemek egyikét 1 Minden elem Helytelenül írt válaszok 0 Maximális pontszám 2 A helyes válasz tartalma és a pontozási utasítások.
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
Válaszelemek
1) Ó
–
+H
+
= H
2
O
2) A sav jelenléte a természetes vízben alacsony értéket okoz ennek a víznek
Kálcium hidroxid
semlegesíteni
nem
savanyú
otu
, és az értékek nőnek A válasz helyes és teljes, tartalmazza az összes fenti elemet A válasz tartalmazza a fenti elemek egyikét 1 A válasz minden eleme hibásan van megírva 0 Maximális pontszám 2
6
7
8
VLOOKUP
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
1) Elektronikus mérleget állítottak össze) Azt jelzi, hogy a kén oxidációs állapota –2 (vagy H
2
S) redukálószer, a vas pedig +3 oxidációs állapotú vagy Fe
2
O
3
) - oxidálószer
3) A reakcióegyenletet összeállítottuk
3H
2
S + Fe
2
O
3
= 2FeS + S + 3
H
2
O A válasz helyes és teljes, tartalmazza az összes fenti elemet. a helyes válaszról és a pontozási utasításokról
n
Iyu
Pontok
A transzformációs sémának megfelelő reakcióegyenleteket írtam fel
1) Fe + 2HCl = FeCl
2
+H
2 2) FeCl
2
+ 2AgNO
3
= Fe(NO
3
2
+ 2Ag
C
l
3) Fe (NO
3
2
+ 2KOH = F
e(OH)
2
.)
n
Iyu
Pontok
Válaszelemek
1)
VAL VEL
2
N
6
+Cl
2
→
VAL VEL
2
N
5
Cl+HCl
2) 2C
3
H
6
+ 9O
2
→
6C
O
2
+ 6
H
2
O Törtegyütthatók lehetségesek) A válasz helyes és teljes, tartalmazza az összes fenti elemet Hiba történt a válasz egyik elemében 1 A válasz minden eleme hibásan van megírva 0 Maximális pontszám
9
10
12
VLOOKUP
. Kémia. 11. évfolyam. Válaszok 2017. Az Orosz Föderáció Oktatási és Tudományos Szövetségi Felügyeleti Szolgálata A helyes válasz tartalma és az értékelési utasítások
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
1) Összeállítottuk a propán égési reakciójának egyenletét
VAL VEL
3
N
8
+ O →
CO + HO) n(
VAL VEL
3
N
8
) = 4,4/44 = 0,1 mol COCH mol) O) = 0,3 · 22,4 = 6,72 l A válasz helyes és teljes, tartalmazza az összes fenti elemet, a válasz fenti elemei közül kettő helyesen van írva 2 Javítsa ki a fentiek egyikét a válasz elemei le vannak írva 1 A válasz minden eleme hibásan van felírva 0 Maximális pontszám 3 A helyes válasz tartalma és a pontozási utasítások
n
Iyu
Pontok
A diagramnak megfelelő reakcióegyenleteket írtam fel
1)
C
H
3
CH
CH
2
+H
2
O
H
2
ÍGY
4
, t
°
CH
3
CH
CH
3
Ó
CH
3
CC
H
3
O
+ macska+ víz n. r-r,
t
°
+ Egyéb reakcióegyenletek, amelyek nem mondanak ellent a reakcióegyenletek megadásának feltételeinek, megengedettek
.)
Három reakcióegyenlet helyesen van felírva Két reakcióegyenlet helyesen van felírva 2 Egy reakcióegyenlet helyesen van felírva 1 Minden egyenlet rosszul van felírva, vagy nincs válasz 0 Maximális pontszám A helyes válasz tartalma és a pontozási utasítások
n
Iyu
(Továbbá, keressen a válasz olyan más megfogalmazásait is, amelyek nem torzítják el a jelentését
Pontok
Válaszelemek
1)m
(NaCl) = 4,5 g
2) víz) = 495,5 g
A válasz helyes és teljes, tartalmazza az összes fenti elemet A válasz tartalmazza a fenti elemek egyikét 1 A válasz minden eleme hibásan van megírva 0 Maximális pontszám 2
13
14
15
VPR Össz-orosz tesztmunka - Kémia 11. osztály
Magyarázatok az összoroszországi tesztmunka mintájához
Amikor megismerkedik egy minta tesztmunkával, ne feledje, hogy a mintában szereplő feladatok nem tükrözik mindazokat a készségeket és tartalmi kérdéseket, amelyeket az összoroszországi tesztmunka részeként tesztelnek. A munkában tesztelhető tartalmi elemek és készségek teljes listája a tartalmi elemek és a diplomások képzési szintjére vonatkozó követelmények kodifikátorában található egy teljes orosz kémia teszt kidolgozásához. A minta tesztmunka célja, hogy képet adjon az összoroszországi tesztmunka felépítéséről, a feladatok számáról és formájáról, valamint azok összetettségi szintjéről.
Útmutató a munka elvégzéséhez
A teszt 15 feladatot tartalmaz. A kémiai munka elvégzésére 1 óra 30 perc (90 perc) áll rendelkezésre.
Válaszait fogalmazza meg a munka szövegében a feladatokhoz tartozó utasítások szerint. Ha hibás választ ír le, húzza át, és írjon mellé egy újat.
A munkavégzés során a következő kiegészítő anyagokat használhatja:
– Kémiai elemek periódusos rendszere D.I. Mengyelejev;
– a sók, savak és bázisok vízben való oldhatóságának táblázata;
– fémfeszültségek elektrokémiai sorozatai;
– nem programozható számológép.
A feladatok elkészítésekor használhat vázlatot. A tervezetben szereplő bejegyzéseket nem vizsgáljuk felül és nem értékeljük.
Javasoljuk, hogy a feladatokat a megadott sorrendben végezze el. Időmegtakarítás érdekében hagyjon ki egy olyan feladatot, amelyet nem tud azonnal végrehajtani, és lépjen a következőre. Ha az összes munka elvégzése után marad ideje, visszatérhet az elmulasztott feladatokhoz.
Az elvégzett feladatokért kapott pontok összegzésre kerülnek. Próbálj meg minél több feladatot teljesíteni, és szerezd meg a legtöbb pontot.
Sok sikert kívánunk!
1. A kémia tantárgyból ismeri a keverékek szétválasztásának alábbi módszereit: ülepítés, szűrés, desztilláció (desztilláció), mágneses hatás, bepárlás, kristályosítás. Az 1–3. ábrák példákat mutatnak be néhány felsorolt módszer alkalmazására.
A keverékek szétválasztására szolgáló alábbi módszerek közül melyik használható a tisztításhoz:
1) liszt vasreszelékből, amely belekerült;
2) víz a benne oldott szervetlen sókból?
Jegyezze fel a táblázatba az ábra számát és a keverék elválasztásának megfelelő módszerének megnevezését!
a vasreszeléket mágnes vonzza
A desztilláció során a vízgőz lecsapódása után sókristályok maradnak az edényben
2. Az ábra valamilyen vegyi anyag atomjának elektronszerkezetének modelljét mutatjaelem.

A javasolt modell elemzése alapján hajtsa végre a következő feladatokat:
1) azonosítsa azt a kémiai elemet, amelynek atomja ilyen elektronszerkezettel rendelkezik;
2) tüntesse fel a periódusszámot és a csoportszámot a kémiai elemek periódusos rendszerében D.I. Mengyelejev, amelyben ez az elem található;
3) határozza meg, hogy az egyszerű anyag, amely ezt a kémiai elemet képezi, fém vagy nem fém.
Válaszait írja be a táblázatba!
Válasz:
N; 2; 5 (vagy V); nem fém
egy kémiai elem meghatározásához meg kell számolni az elektronok teljes számát, amit a (7) ábrán látunk.
a periódusos rendszerből könnyen meghatározhatjuk az elemet (a talált elektronok száma megegyezik az elem rendszámával) (N-nitrogén)
ezt követően meghatározzuk a csoport számát (függőleges oszlop) (5) és ennek az elemnek a jellegét (nem fém)
3. A kémiai elemek periódusos rendszere D.I. Mengyelejev– gazdag információs tárház a kémiai elemekről, tulajdonságaikról és vegyületeik tulajdonságairól, ezen tulajdonságok változásának mintázatairól, az anyagok kinyerésének módjairól, valamint a természetben való elhelyezkedésükről. Például ismert, hogy egy kémiai elem rendszámának periódusonkénti növekedésével az atomok sugara csökken, csoportokban pedig nő.
Ezeket a mintákat figyelembe véve rendezze a következő elemeket növekvő atomi sugarak sorrendjében: N, C, Al, Si. Írja le az elemek megnevezését a kívánt sorrendben!
Válasz: _________________________________
N → C → Si → Al
4. Az alábbi táblázat a molekula- és ionszerkezettel rendelkező anyagok jellemző tulajdonságait sorolja fel.
Ezen információk alapján határozza meg, milyen szerkezetűek a nitrogén N2 és a konyhasó NaCl anyagok. Válaszát írja be a kijelölt helyre:
1) nitrogén N2 ________________________________________________________________________
2) konyhasó NaCl ________________________________________________________
nitrogén N2 – molekulaszerkezet;
konyhasó NaCl – ionos szerkezet
5. Az összetett szervetlen anyagok feltételesen eloszthatók, azaz négy csoportba sorolhatók, a diagramon látható módon. Ezen a diagramon mind a négy csoporthoz írja be a csoportok hiányzó nevét vagy az ebbe a csoportba tartozó anyagok kémiai képleteit (egy példa a képletekre).

A csoportok nevét felírjuk: bázisok, sók;
a megfelelő csoportok anyagainak képleteit írjuk le
CaO, bázisok, HCl, sók
Olvassa el a következő szöveget, és hajtsa végre a 6–8.
Az élelmiszeripar az E526 élelmiszer-adalékanyagot használja, amely a kalcium-hidroxid Ca(OH)2. Gyümölcslevek, bébiételek, ecetes uborka, konyhasó, édességek és édességek előállításához használják.
A kalcium-hidroxid ipari méretekben is előállítható kalcium-oxid vízzel való összekeverésével, ezt a folyamatot kioltásnak nevezik.
A kalcium-hidroxidot széles körben használják építőanyagok, például mész-, vakolat- és gipszhabarcsok gyártásában. Ez a képességének köszönhető kölcsönhatásba lépnek a CO2 szén-dioxiddal tartalmazza a levegő. A kalcium-hidroxid-oldat ugyanazt a tulajdonságát használják a levegő szén-dioxid-tartalmának mérésére.
A kalcium-hidroxid hasznos tulajdonsága, hogy flokkulálószerként működik, amely megtisztítja a szennyvizet a szuszpendált és kolloid részecskéktől (beleértve a vassókat is). A víz pH-értékének növelésére is használják, mivel a természetes víz tartalmaz anyagokat (pl. savak), korróziót okoz a vízvezetékekben.
1. Írjon fel egy molekulaegyenletet a kalcium-hidroxid előállítására irányuló reakcióra, amely
szerepel a szövegben.
2. Magyarázza meg, miért hívják ezt a folyamatot kioltásnak!
Válasz:__________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O = Ca(OH) 2
2) Amikor a kalcium-oxid kölcsönhatásba lép vízzel, nagy mennyiség szabadul fel
hőmennyiség, így a víz felforr és süvít, mintha forró szenet ütne, amikor a tüzet vízzel oltják el (vagy „ezt a folyamatot oltásnak nevezik, mert ennek eredményeként oltott mész képződik”)
1. Írja fel a kalcium-hidroxid és a szén-dioxid reakciójának molekuláris egyenletét!
gáz, amit a szövegben említettek.
Válasz:__________________________________________________________________________
2. Magyarázza el, hogy ennek a reakciónak mely jellemzői teszik lehetővé a detektáláshoz való felhasználását!
szén-dioxid a levegőben.
Válasz:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) A reakció eredményeként oldhatatlan anyag képződik - kalcium-karbonát, az eredeti oldat zavarosságát figyeljük meg, ami lehetővé teszi a szén-dioxid jelenlétének a levegőben való megítélését (minőségi
reakció CO 2-ra)
1. Írjon egy rövidített ionegyenletet a közötti szövegben említett reakcióra!
kalcium-hidroxid és sósav.
Válasz:__________________________________________________________________________
2. Magyarázza meg, miért használják ezt a reakciót a víz pH-értékének növelésére!
Válasz:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH – + H + = H 2 O (Ca(OH)2+ 2HCl = CaCl2 + 2H2O)
2) A sav jelenléte a természetes vízben alacsony pH-értéket okoz ennek a víznek. A kalcium-hidroxid semlegesíti a savakat és megemeli a pH-értéket
A pH-skála 0-14 között van. 0-6 - savas környezet, 7 - semleges környezet, 8-14 - lúgos környezet
9. Adjuk meg a redox reakció diagramját.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Készítsen elektronikus mérleget ehhez a reakcióhoz.
Válasz:__________________________________________________________________________
2. Azonosítsa az oxidálószert és a redukálószert.
Válasz:__________________________________________________________________________
3. Rendezd el az együtthatókat a reakcióegyenletben!
Válasz:__________________________________________________________________________
1) Elektronikus egyenleget állítottak össze:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 – 2ē → S 0 | 2 | 1 |
2) Azt jelzik, hogy a –2 oxidációs állapotú kén (vagy H 2 S) redukálószer, a +3 oxidációs állapotú vas (vagy Fe 2 O 3) pedig oxidálószer;
3) A reakcióegyenletet összeállítottuk:
3H 2 S + Fe 2 O 3 = 2 FeS + S + 3H 2 O
10. Az átalakítási séma a következő:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Írja fel a végrehajtható reakciók molekulaegyenleteit!
a jelzett átalakításokat.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
A transzformációs sémának megfelelő reakcióegyenletek fel vannak írva:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 = Fe(NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Más olyan egyenletek is megengedettek, amelyek nem mondanak ellent az egyenletek megadásának feltételeinek
reakciók.)
11. Állítson fel egyezést egy szerves anyag képlete és az osztály/csoport között!, amelyhez ez az anyag tartozik: minden betűvel jelölt pozícióhoz válassza ki a megfelelő számmal jelölt pozíciót.
Jegyezze fel a kiválasztott számokat a táblázatba a megfelelő betűk alá.
Válasz:
| A | B | BAN BEN |
- C3H8 - CnH2n+2 - alkán
- C3H6 - CnH2n-alkén
- C2H6O - CnH2n+2O- alkohol
12. A javasolt kémiai reakciósémákba illessze be a hiányzó anyagok képleteit és rendezze el az együtthatókat!
1) C 2 H 6 + ………………… → C 2 H 5 Cl + HCl
2) C 3 H 6 + ………………… → CO 2 + H 2 O
1) C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Tört esélyek lehetségesek.)
13. Propán égés alacsony mérgező kibocsátással a légkörbe Ezért sok területen energiaforrásként használják, például gázgyújtókban és vidéki házak fűtésére.
Mekkora térfogatú szén-dioxid (CO) keletkezik 4,4 g propán teljes elégetésekor?
Írjon részletes megoldást a problémára.
Válasz:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Összeállítottuk a propán égési reakció egyenletét:
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
2) n(C3H8)=4,4/44=0,1 mol
n(CO2)=3n(C3H8)=0,3 mol
3) V(O 2) = 0,3 22,4 = 6,72 l
14. Az izopropil-alkoholt univerzális oldószerként használják: háztartási vegyszerekben, parfümökben és kozmetikumokban, valamint az autók szélvédőmosó folyadékaiban szerepel. Az alábbi diagramnak megfelelően hozzon létre reakcióegyenleteket ennek az alkoholnak a előállításához. A reakcióegyenletek felírásakor használja a szerves anyagok szerkezeti képleteit.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
A sémának megfelelő reakcióegyenletek fel vannak írva:

(Egyéb reakcióegyenletek, amelyek nem mondanak ellent a reakcióegyenletek meghatározásának feltételeinek, megengedettek.)
15. Az orvostudományban a sóoldat a nátrium-klorid 0,9%-os vizes oldata. Számítsuk ki 500 g sóoldat elkészítéséhez szükséges nátrium-klorid és víz tömegét. Írjon részletes megoldást a problémára.
Válasz:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 g
2) m(víz) = 495,5 g
m(oldat) = 500g m(só) = x
x/500 * 100% = 0,9%
m(só) = 500* (0,9/100) = 4,5 g
© 2017 Az Orosz Föderáció Oktatási és Tudományos Felügyeleti Szövetségi Szolgálata
BEVEZETÉS
A cseppfolyósított szénhidrogén gázok felhasználásával összefüggő veszélyhelyzetek jelenleg egyre gyakrabban fordulnak elő, a szolgáltatási termelés volumenének növekedése miatt. A munka relevanciája annak köszönhető, hogy az iparosodott országokban a tüzek és robbanások okozta károk kolosszálisak és állandó növekedési tendenciát mutatnak. A termelés technikai felszereltségének emelkedésével a tűz- és robbanásveszély is növekszik. A tüzek és robbanások a legtöbb vészhelyzet szerves részét képezik az olaj- és gázfeldolgozó vállalatoknál, ami szükségessé és sürgőssé teszi a megelőzésükre irányuló intézkedések kidolgozását.
A fenntartható fejlődés kérdései - az ilyen gazdasági létesítmények zsúfolt helyekhez közeli területeken történő elhelyezése potenciálisan veszélyes helyzet kialakulásához vezet.
Környezetvédelmi szempont– a tüzek fő hatásformája az égéstermékek és mérgező éghető anyagok által okozott vegyi szennyezés, amely károsan hat a természeti környezetre.
1 Problémaállapot elemzés
A gázipar az üzemanyag- és energiakomplexum egyik alkotóeleme, amely magában foglalja az összes tüzelőanyag-kitermelést és -feldolgozást (üzemanyagipar), a villamosenergia-termelést és annak szállítását végző vállalkozásokat.
A gáznemű tüzelőanyag széleskörű elterjedése a lakás- és kommunális szolgáltatásokban, valamint a szolgáltató szektorban olyan fogyasztói tulajdonságoknak köszönhető, mint a magas energiahatékonyság, a könnyű kezelhetőség és a tiszta égés, valamint a viszonylag alacsony ár.
Ez a rész a cseppfolyósított szénhidrogén gázok ipari felhasználásával és a cseppfolyósított gázok főbb jellemzőivel kapcsolatos információkat tárgyalja. Figyelembe veszik a gáztöltő állomások és a külső gázvezetékek jellemzőit is. A gázipari létesítményekben történt balesetek statisztikái rendelkezésre állnak.
1.1 Ipari jelentősége, propán és egyéb cseppfolyósított gázok felhasználása
Propán- telített szénhidrogén, amelynek kémiai képlete: CH3CH2CH3, színtelen gyúlékony gáz, szagtalan; olvadási hőmérséklet ( t pl) -187,7 0С, forráspont ( t kip) - 42,1 0С. Levegővel kevert robbanási határértéke 2,1-9,5% (térfogat szerint). Megtalálható a természetes és kapcsolódó kőolajgázokban, a CO-ból és H2-ből nyert gázokban, valamint az olajfinomítás során.
A propán a következő tulajdonságokkal rendelkezik:
- magas fűtőérték az égés során; maradék nélkül ég, és helyes használat esetén gyakorlatilag ártalmatlan; könnyen kezelhető; Különböző kapacitású hengerekben bármilyen távolságra szállítható.
Ezek a tulajdonságok a propánt sokoldalú gázzá teszik; Ma széles körben használják mind a termelésben, mind a mindennapi életben.
1.1.1 Propán felhasználása a termelésben
1) Gyárakban és vállalkozásokban végzett gázláng munkák során:
- beszerzési termelésben; fémhulladék vágásához; nem kritikus fémszerkezetek hegesztésére.
Vágott acél vastagsága mm hegesztett acél 2-9 mm
2) Tetőfedő munkákhoz és építőipari helyiségek fűtéséhez
3) Ipari helyiségek fűtésére (farmokon, baromfitelepeken, üvegházakban)
4) Gáztűzhelyekhez, vízmelegítőkhöz az élelmiszeriparban
A propán ideális kommunális tüzelőanyag
1.1.2 Propán használata otthon
- Ételkészítéskor otthon és útközben; víz melegítésére; távoli helyiségek szezonális fűtésére - magánházak, szállodák, farmok; csövek, üvegházak, garázsok hegesztésére gázhegesztő állomásokkal.
1.1.3 Ipari felhasználás
A propán az ipari szintézisek kiindulási terméke: propán-klorid származékokat állítanak elő, a propilént propán katalitikus dehidrogénezésével, a nitrometánt pedig nitrálással (nitroetánnal és nitropropánnal keverve) nyerik. Az elágazó szénláncú szénhidrogéneket (2,3-dimetil-bután, 2-metil-pentán stb.) propánból és propilénből nyerik, amelyek a repülőgép-üzemanyag adalékaként szolgálnak. Egyes rakéta-üzemanyagok propánt tartalmaznak.
A gáz-benzin vagy olajfinomítókban a propán-bután frakciót cseppfolyósítással választják el a könnyebb komponensekből származó kőolajtól, és nyomástartó tartályokban szállítják a gáztöltő állomásokra. A szállítás és tárolás során a keverék kétfázisú állapotban van, azaz gőzei nyomása alatt folyékony állapotban van. A folyékony fázis a henger vagy a tartály geometriai térfogatának legfeljebb 85%-át töltheti ki úgy, hogy gőzpárna maradjon felette.
A propán –35 és +450 C közötti hőmérsékleten magas gőznyomású. Ez lehetővé teszi a cseppfolyósított gázzal működő palackok helyiségen kívüli felszerelését, ha olyan berendezésekben használják, amelyek természetes párolgás közbeni fázisválasztással rendelkeznek. A bután gőznyomása kisebb, ezért a gőzfázisú extrakciós berendezésekben csak pozitív hőmérsékleten alkalmazzák, de a szállítás során előnye van a propánnal szemben: minél több bután keveredik propánnal a tartályban, annál alacsonyabb a gőznyomás és a kisebb a tartály elszakadásának veszélye. A propán-bután keverék gőzei színtelenek és szagtalanok. ezért illatosító anyagokat (etil-merkaptán) adnak hozzájuk.
1.1.4 Felhasználás üzemanyagként a közlekedésben
A cseppfolyósított gáz központosított készlete meghaladja az évi 6 millió tonnát, amelyből különböző becslések szerint akár 1,3-1,5 millió tonnát is külföldre szállítanak nagykereskedelemben, elsősorban kisméretű exportáló magáncégek. Az orosz autóüzemanyag-piac éves szinten 600 ezer tonna.
A gázüzemanyag és gáztöltő állomások iránti potenciális kereslet óriási. A legtöbb orosz városban a gáz feltöltéséhez 1-1,5 órát kell állnia.
Az értékesítési piac minimális kapacitása az előzetes becslések szerint évekig a következő:
- közepes és kis teljesítményű sűrített gáz töltőállomások 180 köbméterig. m/óra körülbelül $ - 150-180 egység áron;
- cseppfolyósított gáz töltőállomások körülbelül 30 000 USD - 400-450 egység áron;
-gázpalackok sűrített gázhoz darabonként 150 és 200 dollár közötti áron - 20-25 ezer darab;
-gázos autóipari berendezések 150-200 dolláros áron készletenként - 200 ezer készlet.
A felsorolt típusú berendezéseket Kanadában, az USA-ban, Argentínában, Európában (Olaszország, Németország) és Oroszországban gyártják.
Összességében a felszerelések becsült piaca önmagában körülbelül egymillió dollárt tesz ki. Az oroszországi gáztöltő üzletág jövedelmezősége:
- cseppfolyósított benzinkutaknál - 80-100%;
- sűrített benzinkutaknál - 20-40%;
- garázson belüli típusú sűrített benzinkutaknál - akár 400%.
Az elemzés azt mutatja, hogy 2005-ben és az azt követő években 200-350 millió dollárra tehető a profit az orosz gazdaság ezen szektorában.
Tekintsük a gáz előnyeit a benzinnel és a gázolajjal szemben. Az előnyök mind a metánra, mind a propán-butánra vonatkoznak:
1. A motor nagyjavítási időszakának 1,5-szeresének növelése. A motor henger-dugattyús csoportja hosszabb ideig tart (a gáz nem mossa le az olajat a hengerfalakról, és jobban keveredik a levegővel, ami hozzájárul az egyenletesebb égéshez);
2. A motorolaj élettartamának növelése 1,5....2-szeresére. Az olaj ritkábban cserélhető, lassabban veszíti el tulajdonságait;
3. Gázon végzett munka során nincs detonáció (oktánszáma több, mint 100);
4. A motor zajszintjének csökkentése 3.....8 dB-lel (legalább 2-szer);
5. A gyújtógyertyák élettartama 40%-kal megnövekedett;
6. A kipufogógázok toxicitásának csökkentése: CO - 2...3-szor, CH - 1,3...1,9-szer, sokkal kevesebb korom képződik, kevésbé káros kipufogógáz;
7. A kipufogó füstjének csökkentése (dízelmotoroknál) 2...4-szeresére.
A gázpalack-berendezés (GCA) telepítésekor szinte semmi sem változik az autó kialakításában. Csak egy mágnesszelepet helyeznek be az üzemanyagvezeték résébe, hogy elzárják a benzinellátást. A többi standard alkatrész és alkatrész nem változtatható, a gázberendezés egy olyan kiegészítés, amely bármikor lecsavarható és felszerelhető egy másik autóra. A GBA beszerelése után az autó kétféle üzemanyaggal - gázzal és benzinnel - vezethet.
Az USA-ban, Kanadában, Európában és itthon előállított cseppfolyósított gázokat (járművekhez propán-bután keveréket) a kapcsolódó gázból az olaj- és gáztermelés, valamint az olaj- és gázfeldolgozás során előállító üzemek alkalmazása lehetővé teszi saját gázmennyiség beszerzését. évi 3-4 millió tonnáig, viszonylag kis tőkebefektetéssel.
Így azt találjuk, hogy a fejlődő orosz piacon minden feltétel adott egy sikeres gáztöltő vállalkozás elindításához.
1.2 Propán előállítás
A propán, valamint a telített szénhidrogének előállítása során természetes forrásokat (gáz, olaj stb.) és szintetikus előállítási módszereket alkalmaznak.
A propán széles körben elterjedt a természetben. Földgázban található (legfeljebb 5%), olajban oldva.
1) Olajrepedés. A krakkolás során a fő folyamatok a szénlánc homolitikus hasítása egyidejű izomerizációval és ciklizálással, valamint a szénhidrogén-hidrogénezés telítetlen vegyületek képződésével. E termékek szerkezetét a kezdeti telített szénhidrogén szerkezete és a technológiai krakkolási rendszer határozza meg. A repedést 1891-ben találták fel.
C5H12 C3H8 + C2H4;
Pentán propán-etilén
2) Szén hidrogénezése: keverés és melegítés nehéz kenőolajokkal és katalizátorral (vas-oxidok):
3) Telítetlen szénhidrogének hidrogénezése:
Propilén H2 propán
4) Szintézis szén-monoxidból és hidrogénből (szintézisgáz). Ebben az esetben nikkelt vagy kobaltot használnak katalizátorként:
nCO + (2n+1)H2 CnH2n+2 + nH2O
1.3 Tároláspropán
A cseppfolyósított szénhidrogén gázokat acéltartályokban (1.3. ábra) gőznyomás alatt, valamint földalatti gáztárolókban – bányaüzemben és sórétegekben – tárolják.
DIV_ADBLOCK296">
A propán szivattyúzható. Ebben az esetben azonban szigorúan be kell tartani a biztonsági előírások követelményeit, megsértése esetén a következő veszélyek merülhetnek fel:
§ A légkörbe való szivárgás a tömszelence tömítésein keresztül, valamint azok begyulladása és felrobbanása;
§ Túlmelegedés a szivattyúkban lehetséges robbanással;
§ Gázdugók kialakítása szivattyúkban és csővezetékekben a csővezetékek túlnyomástól való esetleges tönkretételével;
§ Leállás vagy javítás utáni indítás előtt levegő szivárog a rendszerbe vagy annak hiányos eltávolítása.
1.4 A propán gyors elpárolgása
A propán azon folyadékok kategóriájába tartozik, amelyek kritikus hőmérséklete a környezeti hőmérséklet felett van. A fő különbség az ebbe a kategóriába tartozó folyadékok között a „villanó párolgás” jelensége, amely akkor fordul elő, amikor a nyomás csökken a gőzeivel egyensúlyban lévő folyadékot tartalmazó rendszerben. Egy idő után új egyensúlyi állapot jön létre, és a folyadék forráspontja alacsonyabb lesz. Külön kiemeljük azt az esetet, amikor a folyadék zárt rendszerből a környezetbe kerül. Amikor egy propántartály összeomlik, a kezdeti és a végső feltételek így nézhetnek ki:
Kezdeti feltételek | Végső feltételek |
|
Hőmérséklet, 0C | ||
Abszolút nyomás, bar |
A kezdeti állapotból a végső állapotba való átmenet során részleges párolgás következik be. Ha feltételezzük, hogy a folyamat adiabatikusan megy végbe (azaz a rendszer nem vesz fel és nem ad ki hőt), akkor ez azt jelenti, hogy egységnyi folyadéktömeg entalpiája kezdeti körülmények között egyenlő lesz a folyadék entalpiájának összegével. a folyadék elpárolgott része.
Ez az utolsó rész kiszámítható a kérdéses anyag termodinamikai tulajdonságait bemutató táblázatokból vagy diagramokból. A gyakorlatban különféle módszereket alkalmaznak egy anyag termodinamikai tulajdonságainak ábrázolására. Általában olyan diagramokat használnak, amelyekben a nyomás, a hőmérséklet, az entalpia, az entrópia és a gőztartalom változó mennyiségek. Abban különböznek egymástól, hogy milyen mennyiségeket ábrázolnak a tengelyek mentén, például „nyomás-entalpia” vagy „entalpia-entrópia”. A diagramok általában a tengelyek mentén ábrázolt paraméterektől eltérő mennyiségek meghatározására szolgálnak.
https://pandia.ru/text/78/625/images/image005_1.png" width="616" height="411">
1.4. ábra – Azonnal elpárolgott folyadék hányada adiabatikus közelítésben.
Az ábra a folyadék - propán azonnal elpárolgott részének adiabatikus közelítésben (TAFF) való hányadának a kezdeti hőmérséklettől való függését mutatja. A számításokat a következő képlet segítségével végeztük:
TAFТ=(НТ-НХ)/LX;
ahol TAFТ az azonnal elpárolgott folyadék hányada adiabatikus közelítésben T hőmérsékleten;
NT – a folyadék fajlagos entalpiája hőmérsékleten
НХ - a folyadék fajlagos entalpiája a forrásponton légköri nyomáson;
LX a párolgás fajlagos látens hője a forrásponton légköri nyomáson.
A TAFF kiszámításakor a következőket feltételezzük:
1) Párolgáskor a gőz egyensúlyban van a folyékony fázissal. A valóságban ez nem történik meg, mivel az eredetileg kibocsátott gőz magasabb hőmérsékletű lesz, mint a maradék folyadék. A számítások során úgy ítélték meg, hogy ez a hatás nagyon jelentéktelen.
2) Adiabatikus folyamatok. A gyors párolgás folyamata nagyon gyorsan megy végbe, ezért a környezet hőnyeresége nagy valószínűséggel elhanyagolható. Sokkal jelentősebb itt a hab és a kifröccsenés mértéke a környezetbe kibocsátott folyadék mennyiségére.
1.4.1 A párolgási folyamat dinamikája
A termodinamika törvényei bizonyos feltevések alapján lehetővé teszik a villanópárolgási folyamat végső egyensúlyi állapotának előrejelzését. Ezek a törvények azonban nem tartalmazzák az időt, így nem teszik lehetővé, hogy leírjuk a folyadék és a gáz viselkedésének dinamikáját a folyamat során.
A villanópárolgás hidrodinamikájának elemzése három lényeges szempontot foglal magában. Ezek:
1) Azonnali párolgás, amely a nyomástartó edény teljes tönkremenetelével jár;
2) Azonnali párolgás, ha a folyadék szintje felett szivárog gőz-folyadék rendszerben;
3) Azonnali párolgás, ha a gőz-folyadék rendszerben a folyadék szintje alatt van szivárgás.
Az iparban számos olyan folyamat létezik, amelyekben a gyorspárologtatás szerves részét képezi. Ennek a folyamatnak az elemzése és kísérleti tanulmányozása szükséges a folyamatszámításokhoz, amelyek magukban foglalják a gyorskazánok, a gyorsdesztillációs és a gyorsbepárló rendszerek számításait.
1.4.2 Azonnali elpárolgás a teljes megsemmisítés után
A nyomás alatt lévő edény teljes megsemmisülése annak hirtelen körülbelül egyenlő részekre való szétesését jelenti, ami meglehetősen ritkán történik. Ennek ellenére a jelenség előfordul, és gyúlékony és mérgező gőzök felszabadulásával jár.
Hadd becsüljük meg hozzávetőlegesen az ilyen események időskáláját.
A villanópárolgáshoz szükséges minimális időt elméletileg megkaphatjuk abból a feltételezésből kiindulva, hogy a folyamat végén levegővel el nem keveredett gőzfelhő képződik. A pillanatnyi párolgás idejét azt az időt kell érteni, amikor a pillanatnyi párolgó folyadék felszínéről hangsebességgel felszálló gőzkibocsátás eléri a képződött felhő szélét. És így:
Ahol Tf a párolgási idő, Rc a gőzhéj sugara, Cv a hang sebessége a gőzben.
A félgömb sugarát a következő kifejezés határozza meg:
Ezért: r=(0,48V)1/3=0,78V1/3;
A felhő sugarának kiszámításához először meg kell becsülni a felhő térfogatát, figyelembe véve az első kibocsátás térfogatának és a gyors elpárolgás utáni folyadék térfogatának kombinációját. A gőzterület terjedési sugarát a félgömb sugara és a folyadék pillanatnyi párolgás előtti sugara közötti különbség határozza meg. A legtöbb esetben azonban elegendő kivonni a folyadék kezdeti térfogatának sugarát egy olyan félgömb sugarából, amelynek térfogata megegyezik az elpárolgott gőz térfogatával.
Ennélfogva,
![]() /Сv;
/Сv;
100 m3 propánra 10 bar nyomáson: TAFF=0,38; Ef=257 – a gőz és a folyadék fajlagos térfogatának aránya propánra légköri nyomáson; Сv=300 m/s; Akkor:
Tf=0,78*((100*257*0,38)-100)1/3/300=0,055 s.
Hasonlítsuk össze a kapott eredményt a nyomástartó edény teljes tönkremenetelének idejével. Ha feltételezzük, hogy a roncsolást a félgömb alapjának kerülete mentén hangsebességgel terjedő repedés okozza acélban, akkor ez 2Pr/Cs másodperc alatt következne be. 100 m3 térfogatú félgömbnél r=3,63 m, kerülete 22,8 m, Cs=3200 m/s, T=0,007 s.
A fent leírt helyzet nem reális, már csak azért is, mert nem léteznek félgömb alakú tartályok, és egy ilyen repedés előfordulása szinte mindig felrobbanást okoz, a tartály közelében lévő levegő környezet súlyos deformációjával. A felszabadulás során keletkezett felhő keveredik a levegővel. Ráadásul a gőz nyugalmi állapotból kezdi meg a mozgását, és a hangsebességet még a kezdeti pillanatban sem valószínű, hogy elérjük, és miután a nyomás egy bizonyos kritikus pontra csökken, még elméletileg sem lesz elérhető. Ezért a gyorspárologtatási folyamat tényleges befejezési ideje hosszabb lesz a fent kiszámítottnál.
A gyakorlatban a gyors párolgás nagyon hevesen megy végbe. Amint a folyékony massza külső felülete megszabadul a gőzétől és a külső réteg szétesik, az alsó réteg felszabadul. Ebben az esetben úgy gondolják, hogy a gyors elpárolgás ideje alatt a folyadék habmasszává alakul. Az erőszakos szétesés során kibocsátott cseppek túlnyúlhatnak az elméletileg számított gőzburokon. Ugyanakkor a gőz expanziója során keletkező impulzus a gőz kibocsátásához vezet a környező légkörbe, ahol keveredik a levegővel, gőz-levegő keverék felhőt képezve. Feltételezzük, hogy a pillanatnyi párolgás során folyadékcseppek is beszívódnak a kialakuló gőzfelhőbe, és a folyadékfázis tömege megegyezik a gőzfázis tömegével. Ezt a nézetet a súlyos veszélyekkel foglalkozó tanácsadók bizottsága elfogadta. Lehetséges, hogy a gőz tágulása, még ha szubszonikus sebességgel történik is, összenyomja az előtte lévő levegőt, ami hasonló lökéshullámot hoz létre, mint a vegyi robbanás során.
Bár a fenti modell azt feltételezte, hogy a tartályt teljesen elfoglalta a folyadék, a gyakorlatban, kivéve, ha a tartály túl van töltve vagy hidraulikus repesztés miatt meghibásodott, a tartályban gőzfázisnak kell jelen lennie, amely szakadáskor kitágul. Ezért a propántartály teljes felszakadásakor keletkező gőzfelhő mérete attól függ, hogy az edény milyen mértékben van megtöltve folyadékkal a szakadás pillanatában. Tehát esetünkben egy folyadékkal teljesen megtöltött tartály megsemmisítése oda vezethet, hogy a közvetlenül kibocsátott gőz térfogata 100-szor nagyobb lesz, mint az eredeti térfogat. a folyadékkal részben feltöltött tartály 10 bar gőznyomáson történő megsemmisülése csak tízszeres növekedéshez vezet.
1.4.3 Gyors párolgás folyadékszint feletti meghibásodáskor
Tekintsük azt az esetet, amikor egy gyorsan elpárolgó folyadékot tartalmazó tartály a folyadék szintje fölé törik. Még egy kis szivárgás is azt okozhatja, hogy a tartály nyomásán továbbra is gőz szabadul fel, amíg az összes folyadék el nem párolog. Bár a hőt a környezet szolgáltatja, a tartalom a lyukak méretétől függő hőmérsékletre hűl le. Az áramlási sebesség a nyílás méretétől és a tartályban lévő nyomástól függ. Az áramlás kritikus lehet. Ezt a nyomásérték és a helyi hangsebesség határozza meg. Ugyanez az érvelés alkalmazható a tárolótartály gőzterével kapcsolatos csőszakadás eseteire is. Az áramlási sebességet standard módszerekkel számítják ki.
Az a döntés, hogy a folyadékcseppek gőzáramba kerülése jelentős-e, a kiforródás sebességétől és a gőztér magasságától függ. A cikk azzal érvel, hogy a gyors gőzhígítású kazánokban, ahol a kondenzátum elpárolog a nagynyomású fűtőtekercsekről, 3 m/s feletti áramlási sebességnél jelentőssé válik a folyadékcseppek kisnyomású vízgőz általi magával ragadása. A munka azt mutatja, hogy a tálcák közötti nagy távolságú desztillációs oszlopokban a 2 m/s sebesség a beszivárgás küszöbértéke. Így 2-3 m/s-nál kisebb áramlási sebességnél az edény meghibásodása csak gőz áramlásához vezet folyadékcseppek nélkül.
1.4.4 Gyors párolgás a folyadékszint alatti meghibásodáskor
Amikor egy tartály a folyadékszint alatt elromlik egy lapos fal kifolyónyílásában, nagy valószínűséggel egyfázisú folyadékáramlásra lehet számítani. Ebben az esetben a szivárgáson kívülről azonnali párolgás következik be. Ha a szivárgás csőszakadás miatt következik be, a csőben való villogás valószínűleg kétfázisú áramlást eredményez. A villanópárolgás miatt az áramlási sebesség kisebb lesz, mint az egyfázisú folyadékáramoké azonos nyomásesés mellett. A folyadékszint alatti meghibásodás azonban nagyobb tömegáramot eredményez, mint a folyadékszint feletti hasonló méretű meghibásodás.
1.5 A propán élettani és toxikus hatásai
Állati expozíció: 90% propán és 10% oxigén keverékének belélegzése teljes érzéstelenítést okoz macskákban.
Emberi expozíció: Beszámoltak a háztartási tüzelőanyagként való felhasználásra szánt propán okozta öngyilkos halálos mérgezésről. Propánmérgezés esetén nem csak propán van a vérben, a vizeletben vagy az agy-gerincvelői folyadékban, hanem propén is. Egyes propán-származékok metabolizálódnak a szervezetben. Így, amikor a 2-nitropropán-1,3-at 72,8 és 560 mg/m3 koncentrációban lélegezték be patkányokban 48 órán keresztül, több mint fele CO2 formájában (13,7 és 21,9%) szabadult ki a tüdőn keresztül. változatlan molekulaként, vizelettel - 8,1 és 10,7%, széklettel - 10,7 és 5,3%; 25,5 és 11,3% halmozódott fel a szövetekben és a csontokban. A propán hulladéktermék, amely az emberek által kilélegzett levegőben található, bár kis mennyiségben.
Meghatározási módszerek.
Előnyben kell részesíteni a kromatográfiás meghatározást. Hatékony mintavételi abszorbensek (Maslovka, Nowicka) alkalmazása esetén a GLC módszer lehetővé teszi a propán meghatározását. A bioszubsztrátumokban történő meghatározási módszerek szintén gázabszorpción és GLC-n alapulnak.
Megelőzési módszerek. Személyi védelem.
A propán égő beltéri használatakor óvintézkedéseket kell tenni: oxigénhiány esetén a propán égéskor CO és aldehidek keletkeznek, amelyek mérgezést okozhatnak. A munkát befúvó és elszívó szellőzéssel kell ellátni. Munka közben védőszemüveget kell használni.
Sürgősségi ellátás .
Inhalációs mérgezés esetén az áldozatot el kell távolítani a szennyezett légkörből, meg kell szabadítani a szoros ruházattól és meleg helyre kell helyezni (fűtőbetétekkel letakarva). Légzészavar esetén oxigént adunk, ha nincs légzés, azonnal megkezdjük a tüdő mesterséges lélegeztetését. Kávé, erős tea, mustártapasz vagy melegítőpárna a végtagokon. Ha fennáll a tüdőödéma kialakulásának veszélye - korábbi vérvétel, oxigénterápia, kalcium-klorid vagy kalcium-glükonát, intravénás 40%-os glükózoldat stb. A tüdőgyulladás megelőzésére szulfonamidokat és antibiotikumokat alkalmaznak. A glükokortikoidokat (intramuszkulárisan), különösen a kortizon-acetátot (2 ml szuszpenzió), a hidrokortizon-acetátot (2 ml szuszpenzió) vagy a prednizolon-hidrokloridot (0,5 vagy 1,0 ml) írják elő a nem specifikus gyulladásgátló és antitoxikus terápia hatékony eszközeiként. Különös figyelmet kell fordítani a szív- és érrendszer állapotára.
Gázkeverék mérgező hatása
1) Propán-bután
A keverék érzéstelenítést okoz. A mérgező tulajdonságok magas koncentrációban jelentkeznek.
Állatok. A tengerimalacokat inhalációs expozíciónak tették ki (propán és bután egyenlő részekben) 50% (térfogat) koncentrációban 30 percig 30 napig, 30% -os koncentrációban 1 órán át 60 napig és 5% -os koncentrációban 120 napig. Csak 50%-os keverék okozott kisebb hipokróm vérszegénységet.
Emberi. Leírtak mérgezési eseteket az edényeket propán-bután keverékkel megtöltő dolgozók körében. Mérgezési tünetek: izgatottság, kábult állapot, pupillák összehúzódása, a pulzus percenkénti 40-50 ütésre lassulása, nyálfolyás, hányás, majd több órás alvás; másnap a pulzus lassú maradt, hipotenziót és mérsékelt testhőmérséklet-emelkedést észleltek; Hosszan tartó érzéstelenítéssel járó súlyos mérgezés után memóriavesztés lehetséges. Helyi hatás az emberre - a bőrrel érintkezve fagyást okoz, a hatás természete égési sérüléshez hasonlít.
2) Propán-bután-pentán
Állatok.
A propán (139 mg/m3), bután (80 mg/m3) és pentán (32 mg/m3) keverékét 105 napon keresztül folyamatosan belélegző hím patkányokon végzett kísérletekben 90 nap után a testtömeg-gyarapodás lelassulását figyelték meg, az eritrociták, a hemoglobin mennyiségének csökkenése, a neutrofilek fagocita aktivitásának csökkenése, a kondicionált reflexaktivitás gátlása. A levágott állatoknál disztrófiás elváltozásokat észleltek a májban. Valamivel kevésbé kifejezett, de azonos irányú változásokat tapasztaltak az állatoknál, amikor propánkeveréket (11 mg/m3) lélegeztek be azonos körülmények között.
1.6 A cseppfolyósított gázokra jellemző vészhelyzetek és azok következményei.
A szakirodalom szerint az alábbiakban felsoroljuk a létesítményben kezelt veszélyes anyagokkal kapcsolatos legismertebb baleseteket.
1984 San Juanico (Mexikó).
Sorozatos robbanások sorozata, amelyek tűzgolyókat hoznak létre egy C3-C4 folyékony szénhidrogén tárolóparkban a csővezetékből vagy tartályból nagy mennyiségű szénhidrogén szivárgása következtében. A felhőt egy fáklyaszerkezet lángja gyújtotta meg.
A gőzfelhő robbanása egy folyékony propánt tartalmazó csővezeték szakadásából fakadt. Az incidens a történelem legnagyobb gőzfelhő-robbanása lehetett, de a város ritkán lakott területén történt, és a robbanást egy bizonyos idő előzte meg, ami lehetővé tette számos lakos evakuálását. A balesetnek könnyű sérülések kivételével személyi sérülés nem történt. Bár ezt az eseményt korábban detonációnak minősítették, ma már az épületen belüli robbanás okozta deflagrációs átalakulásnak tekintik.
A robbanás mechanikai oka egy 8 hüvelykes (200 mm) csővezeték elszakadása volt, amelyen keresztül 6 MPa nyomáson propánt szállítottak. A csővezeték szakadása után 20 perc telt el a tűz kitöréséig, így a körülötte lévők biztonságos távolságba költözhettek.
A tűz a szivárgástól szélirányban 300 m-re lévő betontömbökből épült raktárépületbe gőz behatolása következtében keletkezett. Az épületben mélyhűtő berendezés volt, és valószínűleg termosztát-szikra okozta a tüzet. Maga az épület is megsemmisült, valószínűleg az első robbanás következtében. A baleset helyszínével szomszédos épületek egyike sem semmisült meg teljesen, ellentétben az 1948. július 28-án Ludwigshafenben (Németország) és az 1979. június 1-jén Flixborough-ban (Egyesült Királyság) történt balesettel.
Az üzemeltetők hozzávetőleg 750 hordóra, azaz 60 tonnára becsülték a kiömlött folyadék mennyiségét. Természetesen nem minden kiömlött anyag vett részt a robbanásban, egy része az alsó gyúlékonysági határ alatti koncentrációban került a levegőbe, ill. néhányat a felső tűzveszélyességi határ feletti koncentrációra. Kellően hosszú kiömlési folyamat esetén végül olyan egyensúlyi állapot lép fel, amelyben a levegőben lévő anyag olyan koncentrációra hígulásának sebessége, amelynél az égés lehetetlen, egyenlővé válik a szivárgás forrásának intenzitásával. A jelentés 500 m hosszúra, 16-20 m szélesre, 4-7 m magasra becsüli a felhő álló állapotát. Egy ilyen felhő 6 ezer m2 területet fed le.
1965 és 1980 között a tűzzel, robbanással vagy mérgezőanyag-kibocsátással járó súlyos balesetekben világszerte 104 haláleset (8%) 104-nél (8%) mérgezőanyag-kibocsátással járt. A nem halálos esetek statisztikái a következők: az érintettek száma összesen 4285 fő, a mérgező kibocsátással érintettek száma 1343 fő (32%). 1984 előtt a mérgezőanyag-kibocsátás miatti áldozatok és halálozások aránya nagyon különbözött a tüzekkel és robbanásokkal járó balesetek arányától. Az 1984. december 3-án Bhopalban (India) történt baleset azonban mintegy 4 ezer emberéletet követelt, és jelentősen módosította ezt az arányt. A mérgező anyagok kibocsátásával járó balesetek minden fejlett ipari országban nagy aggodalomra adnak okot a lakosság számára.
Számos, az iparban széles körben használt mérgező anyagot, amelyek közül a legfontosabb a klór és az ammónia, cseppfolyósított gázok formájában tárolnak legalább 1 MPa nyomáson. Azon tartályok tömítettségének elvesztése esetén, ahol ilyen anyagot tárolnak, a folyadék egy része azonnal elpárolog. Az elpárolgott folyadék mennyisége az anyag természetétől és hőmérsékletétől függ. Egyes mérgező anyagokat, amelyek normál hőmérsékleten folyékonyak, tartályokban (légköri nyomáson) tárolnak, amelyek légzőkészülékkel és megfelelő eszközökkel vannak felszerelve, amelyek megakadályozzák a légkörbe való szivárgást, például speciális aktívszén-csapdával. A tartály tömítettségének elvesztésének egyik lehetséges oka egy inert gáz, például nitrogén túlnyomásának megjelenése lehet a tartály gőzterében, ami a nyomáscsökkentő szelep meghibásodása miatt következik be. egy automatikus nyomásszabályozó rendszer a tartályban. Egy másik ok, hogy a visszamaradt mérgező anyag vízzel együtt távozik, például egy tartály mosásakor.
A tartályokból való szivárgás lehetséges oka lehet a tartályba juttatott túlzott hőmennyiség, például napsugárzás formájában vagy a tárolótérben keletkezett tűz hőterhelése. A tartalommal kémiai reakcióba lépő anyagok bejutása a tartályba szintén mérgező kibocsátást okozhat, még akkor is, ha maga a tartalom alacsony toxicitású volt. Ismertek olyan esetek, amikor a vállalkozásoknál nem szándékos cselekmények következtében, például sósav és fehérítő (nátrium-hipoklorit) összekeverésekor a keletkező klór kiszivárgott. A polimerizációt vagy bomlást felgyorsító anyagok tartályba juttatása olyan mennyiségű hőt bocsáthat ki, amely a tartalom egy részének kiforrását és mérgező kibocsátást eredményezhet.
A kalcium-hidroxidot széles körben használják építőanyagok, például mész-, vakolat- és gipszhabarcsok gyártásában. Ez annak köszönhető, hogy képes kölcsönhatásba lépni a levegőben lévő szén-dioxiddal. A kalcium-hidroxid-oldat ugyanazt a tulajdonságát használják a levegő szén-dioxid-tartalmának mérésére.
A kalcium-hidroxid hasznos tulajdonsága, hogy flokkulálószerként működik, amely megtisztítja a szennyvizet a szuszpendált és kolloid részecskéktől (beleértve a vassókat is). A víz pH-értékének növelésére is használják, mivel a természetes víz olyan anyagokat (például savakat) tartalmaz, amelyek korróziót okoznak a vízvezetékekben.
Írja fel a szövegben említett kalcium-hidroxid és szén-dioxid reakciójának molekuláris egyenletét.2. Magyarázza el, hogy ennek a reakciónak mely jellemzői teszik lehetővé a szén-dioxid kimutatására a levegőben!
Írja fel a szövegben említett kalcium-hidroxid és sósav reakciójának rövidített ionegyenletét.2. Magyarázza el, miért használják ezt a reakciót a víz pH-értékének növelésére.
9. Adjuk meg a redoxreakció sémáját:
Írj elektronmérleget erre a reakcióra.2. Adja meg az oxidálószert és a redukálószert.
Rendezd el az együtthatókat a reakcióegyenletben!
10. A transzformációs séma adott: → → →
Írjon fel olyan molekuláris reakcióegyenleteket, amelyek segítségével végrehajthatja ezeket az átalakításokat!
Határozzon meg egyezést egy szerves anyag képlete és az osztály/csoport között, amelyhez az anyag tartozik: minden betűhöz igazítsa az osztályt
Illessze be a hiányzó anyagok képleteit a javasolt kémiai reakciósémákba, és rendezze el az együtthatókat!
1) → 2) → ![]()
 13. A propán alacsony mérgező kibocsátással ég a légkörbe, ezért számos alkalmazásban energiaforrásként használják, például gázgyújtóknál és vidéki házak fűtésénél. Mekkora térfogatú szén-dioxid (CO) keletkezik 4,4 g propán teljes elégetésekor? Írjon részletes megoldást a problémára.
13. A propán alacsony mérgező kibocsátással ég a légkörbe, ezért számos alkalmazásban energiaforrásként használják, például gázgyújtóknál és vidéki házak fűtésénél. Mekkora térfogatú szén-dioxid (CO) keletkezik 4,4 g propán teljes elégetésekor? Írjon részletes megoldást a problémára.
Az izopropil-alkoholt univerzális oldószerként használják: háztartási vegyszerekben, parfümökben és kozmetikumokban, valamint az autók szélvédőmosó folyadékaiban szerepel. Az alábbi diagramnak megfelelően hozzon létre reakcióegyenleteket ennek az alkoholnak a előállításához. A reakcióegyenletek felírásakor használja a szerves anyagok szerkezeti képleteit.
15. Az orvostudományban a sóoldat a nátrium-klorid 0,9%-os vizes oldata. Számítsuk ki 500 g sóoldat elkészítéséhez szükséges nátrium-klorid és víz tömegét. Írjon részletes megoldást a problémára.
 7.
Válaszelemek:
7.
Válaszelemek:
2) A reakció eredményeként oldhatatlan anyag képződik - kalcium-karbonát, az eredeti oldat zavarossága figyelhető meg, ami lehetővé teszi a szén-dioxid jelenlétének a levegőben való megítélését (kvalitatív reakció)
8. Válaszelemek:
2) A sav jelenléte a természetes vízben alacsony pH-értéket okoz ennek a víznek. A kalcium-hidroxid semlegesíti a savakat és megemeli a pH-értéket.
9. Magyarázat. 1) Elektronikus egyenleget állítottak össze:
![]()
2) Jelöljük, hogy a –2 (vagy) oxidációs állapotú kén redukálószer, a +3 (vagy) oxidációs állapotú vas pedig oxidálószer;
3) A reakcióegyenletet összeállítottuk:
10. A transzformációs sémának megfelelő reakcióegyenletek fel vannak írva:
15. Magyarázat. Válaszelemek: 1) = 4,5 g 2) = 495,5 g