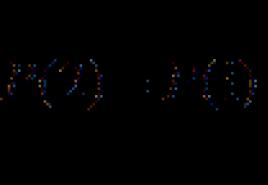A molekulák energia szerinti statisztikai termodinamikai eloszlása. statisztikai fizika
Legyen két egyforma edény összekapcsolva úgy, hogy az egyik edényből a gáz a másikba áramolhasson, és legyen a kezdeti pillanatban minden gázmolekula egy edényben. Egy idő után a molekulák újraeloszlása következik be, ami egy egyensúlyi állapot kialakulásához vezet, amelyet az jellemez, hogy mindkét edényben azonos valószínűséggel találnak molekulákat. A kezdeti egyensúlytalan állapotba való spontán átmenet, amelyben minden molekula az egyik edényben koncentrálódik, gyakorlatilag lehetetlen. Az egyensúlyi állapotból a nem egyensúlyi állapotba való átmenet folyamata nagyon valószínűtlen, mivel a paraméterek relatív ingadozása nagyszámú részecske esetén az edényekben nagyon kicsi.
Ez a következtetés megfelel a termodinamika második főtételének, amely szerint a termodinamikai rendszer spontán módon megy át nem egyensúlyi állapotból egyensúlyi állapotba, míg a fordított folyamat csak a rendszert érő külső hatások hatására lehetséges.
Entrópia és valószínűség
Az entrópia egy termodinamikai mennyiség, amely a spontán termodinamikai folyamatok irányát jellemzi. A legvalószínűbb egyensúlyi állapot az entrópiamaximumnak felel meg.
Legyen egy térfogatú edény V 0 egy molekulát tartalmaz. Annak a valószínűsége, hogy egy részecskét egy bizonyos térfogaton belül találnak V< V 0 , amely az ér belsejében van elszigetelve, egyenlő a . Ha az edény nem egy, hanem két részecskét tartalmaz, akkor ezek egyidejű kimutatásának valószínűségét a megadott térfogatban az ebben a térfogatban lévő részecskék megtalálásának valószínűségének szorzataként határozzuk meg:
 .
.
Mert N részecskék egyidejű észlelésének valószínűsége a térfogatban V lesz
 .
.
Ha ebben az edényben két kötetet különböztetünk meg V 1 és V 2 akkor felírhatjuk annak valószínűségi arányait, hogy minden molekula a megadott térfogatban van:
 .
.
Határozzuk meg az entrópia növekedését az izoterm folyamatban

ideális gáz tágulása abból V 1 előtt V 2 :
Az arányt használva a valószínűségek a következők:
 .
.
A kapott kifejezés nem határozza meg az entrópia abszolút értékét egyetlen állapotban sem, hanem csak lehetővé teszi, hogy megtaláljuk az entrópiák különbségét két különböző állapotban.
Az entrópia egyértelmű meghatározásához használja a statisztikai súly G , amelynek értéke pozitív egész számként van kifejezve és arányos a valószínűséggel: G ~ P .
A makroállapot statisztikai súlya Az egyensúlyi mikroállapotok számával számszerűen megegyező értéket nevezzük, amelynek segítségével a vizsgált makroállapot megvalósítható.
A statisztikai súlyra való átállás lehetővé teszi, hogy az entrópiára vonatkozó relációt a formába írjuk Boltzmann képletek a statisztikai entrópiához :
![]()
15. előadás
Transzfer jelenségek
Termodinamikai áramlások
Termodinamikai áramlások A közeg egyik részéből a másikba való anyag, energia vagy impulzus átvitelével kapcsolatos, akkor keletkezik, ha bizonyos fizikai paraméterek értéke eltér a közeg térfogatában.
diffúzióval a keverékekben lévő anyagok koncentrációinak spontán összehangolásának folyamatát. A diffúzió sebessége erősen függ az anyag aggregációs állapotától. A diffúzió gyorsabban megy végbe gázokban és nagyon lassan szilárd anyagokban.
hővezető az a jelenség, amely a környezet különböző pontjain a hőmérséklet kiegyenlítődéséhez vezet. A fémek nagy hővezető képessége annak a ténynek köszönhető, hogy a hőátadás bennük nem az atomok és molekulák kaotikus mozgása miatt megy végbe, mint például a gázokban vagy folyadékokban, hanem a szabad elektronok által, amelyeknek sokkal nagyobb a hőtartalmuk. mozgási sebességek.
Viszkozitás vagy belső súrlódás Nevezzük azt a folyamatot, amikor egy test folyadékban vagy gázban mozog, és a hanghullámok gyengülnek, amikor különböző közegen haladnak át.
A termodinamikai áramlás mennyiségi leírásához bevezetjük a mennyiséget
 , ahol
, ahol
Könyvtár > Fizikai könyvek > Statisztikai fizika
statisztikai fizika
- Aizenshitz R. Irreverzibilis folyamatok statisztikai elmélete. M.: Szerk. Külföldi lit., 1963 (djvu)
- Anselm A.I. Statisztikai fizika és termodinamika alapjai. Moszkva: Nauka, 1973 (djvu)
- Akhiezer A.I., Peletminsky S.V. Statisztikai fizika módszerei. Moszkva: Nauka, 1977 (djvu)
- Bazarov I.P. A statisztikus fizika és termodinamika módszertani problémái. M.: Moszkvai Állami Egyetem Kiadója, 1979 (djvu)
- Bogolyubov N.N. Válogatott statisztikai fizika művek. M.: Moszkvai Állami Egyetem Kiadója, 1979 (djvu)
- Bogolyubov N.N. (ifj.), Sadovnikov B.I. A statisztikai mechanika néhány kérdése. M.: Feljebb. iskola, 1975 (djvu)
- Bonch-Bruevich V.L., Tyablikov S.V. Green-függvény módszer a statisztikai mechanikában. Moszkva: Fizmatlit, 1961 (djvu, 2,61 Mb)
- Vasziljev A.M. Bevezetés a statisztikai fizikába. M.: Feljebb. iskola, 1980 (djvu)
- Vlasov A.A. Nem lokális statisztikai mechanika. Moszkva: Nauka, 1978 (djvu)
- Gibbs JW Statisztikai mechanika alapelvei (speciális alkalmazással kifejtve a termodinamika racionális igazolására). M.-L.: OGIZ, 1946 (djvu)
- Gurov K.P. A kinetikai elmélet alapjai. Módszer N.N. Bogolyubov. Moszkva: Nauka, 1966 (djvu)
- Zaslavsky G.M. Statisztikai irreverzibilitás nemlineáris rendszerekben. Moszkva: Nauka, 1970 (djvu)
- Zakharov A. Yu. Statisztikai fizika rácsmodellei. Velikij Novgorod: NovGU, 2006 (pdf)
- Zakharov A. Yu. Funkcionális módszerek a klasszikus statisztikai fizikában. Velikij Novgorod: NovGU, 2006 (pdf)
- Ios G. Elméleti fizika tantárgy. 2. rész. Termodinamika. Statisztikai fizika. Kvantum elmélet. Atommag fizika. M.: Felvilágosodás, 1964 (djvu)
- Ishihara A. Statisztikai fizika. M.: Mir, 1973 (djvu)
- Kadanov L., Beim G. Kvantumstatisztikai mechanika. Green-függvények módszerei az egyensúlyi és nem egyensúlyi folyamatok elméletében. M.: Mir, 1964 (djvu)
- Katz M. Valószínűségszámítás és kapcsolódó kérdések a fizikában. M.: Mir, 1965 (djvu)
- Katz M. A fizika és a matematika számos valószínűségi problémája. Moszkva: Nauka, 1967 (djvu)
- Kittel Ch. Elemi statisztikai fizika. M.: IL, 1960 (djvu)
- Kittel Ch. Statisztikai termodinamika. M: Tudomány, 1977 (djvu)
- Kozlov V.V. Termikus egyensúly Gibbs és Poincare szerint. Moszkva-Izhevsk: Számítógépes Kutatóintézet, 2002 (djvu)
- Kompaneets A.S. A fizikai statisztika törvényei. lökéshullámok. Szuper sűrű anyag. M.: Nauka, 1976 (djvu)
- Kompaneets A.S. Elméleti fizika tantárgy. 2. kötet Statisztikai törvények. M.: Felvilágosodás, 1975 (djvu)
- Kotkin G.L. Előadások a statisztikai fizikáról, NSU (pdf)
- Krylov N.S. A statisztikai fizika alátámasztásával foglalkozik. M.-L.: A Szovjetunió Tudományos Akadémiájától, 1950 (djvu)
- Kubo R. Statisztikai mechanika. M.: Mir, 1967 (djvu)
- Landsberg P. (szerk.) Termodinamika és statisztikus fizika problémái. M.: Mir, 1974 (djvu)
- Levich V.G. Bevezetés a statisztikai fizikába (2. kiadás) M.: GITTL, 1954 (djvu)
- Libov R. Bevezetés a kinetikai egyenletek elméletébe. M.: Mir, 1974 (djvu)
- Mayer J., Geppert-Mayer M. Statisztikai mechanika. M.: Mir, 1980 (djvu)
- Minlos R.A. (szerk.) Matematika. Új a külföldi tudományban-11. Gibbs-állapotok a statisztikai fizikában. Cikkek kivonata. M.: Mir, 1978 (djvu)
- Nozdrev V.F., Senkevich A.A. Statisztikai fizika tantárgy. M.: Feljebb. iskola, 1965 (djvu)
- Prigogine I. Nem egyensúlyi statisztikai mechanika. M.: Mir, 1964 (djvu)
- Raduskevich L.V. Statisztikai fizika tanfolyam (2. kiadás) M.: Prosveshchenie, 1966 (djvu)
- Reif F. Berkeley fizikatanfolyam. 5. kötet Statisztikai fizika. M.: Nauka, 1972 (djvu)
- Rumer Yu.B., Ryvkin M.Sh. Termodinamika, statisztikai fizika és kinetika. M.: Nauka, 1972 (djvu)
- Rumer Yu.B., Ryvkin M.Sh. Termodinamika Statisztikai fizika és kinetika (2. kiadás). Moszkva: Nauka, 1977 (djvu)
- Ruel D. Statisztikai mechanika. M.: Mir, 1971 (djvu)
- Savukov V.V. A statisztikus fizika axiomatikus elveinek finomítása. SPb.: Balt. állapot tech. univ. "Voenmekh", 2006
Molekuláris fizika,
Termodinamika,
statisztikai fizika,
három pozíciót
1.
az anyag részecskékből áll;
2.
3.
statisztikai módszer átlagolva
termodinamikai módszer
A termodinamika alapelvei
A termodinamika első főtétele
δ K = δ A + dU , ahol dU Kés δ A
A termodinamika második főtétele
1 - Clausius posztulátuma.
2 - Kelvin posztulátuma.
entrópia növekmény (
A termodinamika nulla kezdete (a termodinamika általános törvénye)
Ha a rendszer A B C, majd a rendszer A egyensúlyban van vele C
A fizikai kinetika elemei. A transzfer jelensége termodinamikailag nem egyensúlyi rendszerekben. A gázokban előforduló transzport jelenségek általános egyenlete és igazolása az MKT szerint. Az átviteli együtthatók nyomástól és hőmérséklettől való függése.
Fizikai kinetika(ógörög κίνησις - mozgás) - nem egyensúlyi közegben zajló folyamatok mikroszkopikus elmélete. A kinetikában a kvantum vagy a klasszikus statisztikai fizika módszereivel
Tanulmányozzák a különböző fizikai rendszerekben (gázok, plazma, folyadékok, szilárd anyagok) zajló energia-, impulzus-, töltés- és anyagátviteli folyamatokat, valamint a külső mezők rájuk gyakorolt hatását.
Termodinamikailag nem egyensúlyi rendszerekben speciális visszafordíthatatlanúgynevezett folyamatokat transzfer jelenségek, melynek eredményeként térbeli energia-, tömeg- és lendületátvitel történik. Az átviteli jelenségek közé tartozik hővezető(következtében energiaátvitel)diffúzió(következtében tömegtranszfer) és belső súrlódás(következtében lendületátvitel).
1. Hővezetőképesség. Ha a gáz egyik tartományában a molekulák átlagos kinetikus energiája nagyobb, mint a másikban, akkor idővel a molekulák állandó ütközései miatt a molekulák átlagos kinetikus energiáinak kiegyenlítődésének folyamata következik be, azaz más szóval a hőmérsékletek kiegyenlítése.
Az energia hő formájában történő átadása függ Fourier törvény:
ahol j E -hőáram sűrűsége- a hő formájában átadott energia által meghatározott mennyiség tengelyek x,l - hővezető, - hőmérséklet-gradiens, amely megegyezik a hőmérséklet-változás mértékével egységnyi hosszon x az oldal normál irányban. A mínusz jel azt mutatja, hogy a hővezetés során az energia a csökkenő hőmérséklet irányába kerül átadásra (ezért a jelek j Eés ellentétesek).
2. Diffúzió. A diffúzió jelensége abban rejlik, hogy két szomszédos gáz, folyadék, sőt szilárd anyag részecskéi spontán behatolása és keveredése következik be; a diffúzió e testek részecskéinek tömegének cseréjére redukálódik, keletkezik és addig tart, amíg a sűrűséggradiens fennáll. A molekuláris-kinetikai elmélet kialakulása során viták merültek fel a diffúzió kérdésében. Mivel a molekulák óriási sebességgel mozognak, a diffúziónak nagyon gyorsnak kell lennie. Ha kinyit egy edényt, amelyben szagú anyag van a szobában, akkor a szag meglehetősen lassan terjed. Itt azonban nincs ellentmondás. A légköri nyomású molekuláknak rövid átlagos szabad útjuk van, és más molekulákkal ütközve alapvetően „megállnak” a helyükön.
Egy kémiailag homogén gáz diffúziós jelensége engedelmeskedik Fuc törvénye:
ahol j m -tömegáram-sűrűség- a diffundáló anyag tömege által meghatározott érték egységnyi idő alatt egy egységnyi területen át merőlegesen tengelyek x, D -diffúzió (diffúziós együttható), d r/ d x- sűrűséggradiens, amely megegyezik az egységnyi hosszonkénti sűrűségváltozás sebességével x az oldal normál irányban. A mínusz jel azt mutatja, hogy a tömegátadás a sűrűség csökkenésének irányába történik (ezért az előjelek j més d r/ d x ellentétesek).
3. Belső súrlódás (viszkozitás). A különböző sebességgel mozgó gáz (folyadék) párhuzamos rétegei közötti belső súrlódás létrejöttének mechanizmusa az, hogy a kaotikus hőmozgás következtében a rétegek között molekulák cserélődnek, aminek következtében a gyorsabban mozgó réteg lendülete csökken, lassabban mozog - növekszik, ami a gyorsabban mozgó réteg lelassulásához és a lassabban mozgó réteg gyorsulásához vezet.
A két gázréteg (folyadék) közötti belső súrlódási erő engedelmeskedik Newton törvénye:
ahol h- dinamikus viszkozitás (viszkozitás), d v/ d x- sebességgradiens, amely a sebesség irányváltozásának sebességét mutatja X, a rétegek mozgási irányára merőlegesen, S- terület, amelyen az erő hat F.
Két réteg kölcsönhatása Newton második törvénye szerint olyan folyamatnak tekinthető, amelyben egy impulzus egységnyi idő alatt kerül át egyik rétegből a másikba, a modulus egyenlő a ható erővel. Ekkor ez a kifejezés a következőképpen ábrázolható
ahol jp -lendületi fluxussűrűség- a tengely pozitív irányában egységnyi idő alatt továbbvitt teljes impulzus által meghatározott érték x egyetlen, a tengelyre merőleges területen keresztül X, - sebesség gradiens. A mínusz jel azt jelzi, hogy az impulzus a sebesség csökkenésének irányába kerül.
A diffúziós együttható a hőmérséklet emelkedésével nő:
A hőmérséklet emelkedésével a hővezető képesség is nő:
A viszkozitási együttható hőmérsékletfüggése hasonló a hővezetőképességi együttható függéséhez:
A termodinamika első törvénye (első törvénye) (a hőfolyamatok energiamegmaradásának törvénye). A termodinamika első főtételének alkalmazása gázok izofolyamataira. adiabatikus folyamat. Poisson egyenlet. politropikus folyamat.
A termodinamika első főtétele- A termodinamika három alaptörvényének egyike, a termodinamikai rendszerek energiamegmaradásának törvénye
.A rendszer belső energiájának változása az egyik állapotból a másikba való átmenet során egyenlő a külső erők munkájának és a rendszerbe átvitt hőmennyiség összegével, vagyis csak a kezdeti és a végső állapottól függ. nem függ az átállás módjától. Más szavakkal, a belső energia állapotfüggvény. Ciklikus folyamatban a belső energia nem változik.
δ K = δ A + dU, ahol dU a rendszer belső energiájának teljes differenciája, és δ Kés δ A a rendszernek átadott elemi hőmennyiség és a rendszer által végzett elemi munka, ill.
A termodinamika első főtétele:
§ izobár folyamatban
§ izokhorikus folyamatban ( A = 0)
![]()
§ izoterm folyamatban (Δ U = 0)
![]()
Itt - a gáz tömege, - a gáz moláris tömege, - a moláris hőkapacitás állandó térfogaton, - a gáz nyomása, térfogata és hőmérséklete, és az utolsó egyenlőség csak ideális gázra igaz.
Az anyag szilárd halmazállapota. Olyan állapot, amelyet a térfogat és forma megtartásának képessége jellemez. A szilárd test atomjai csak kis rezgéseket keltenek az egyensúlyi állapot körül. Létezik rövid és hosszú távú rendelés is.
A D. gázokban, folyadékokban és szilárd anyagokban játszódik le, és mind a bennük található idegen anyagok részecskéi, mind a saját részecskéik diffundálhatnak. gázban vagy folyadékban szuszpendált nagy részecskék a Brown-mozgásuk miatt valósulnak meg. A D. leggyorsabban gázokban, lassabban folyadékokban és még lassabban fordul elő szilárd anyagokban, ami az ezekben a közegekben lévő részecskék hőmozgásának természetéből adódik.
Szilárd. Olyan állapot, amelyet a térfogat és forma megtartásának képessége jellemez. A szilárd test atomjai csak kis rezgéseket keltenek az egyensúlyi állapot körül. Létezik rövid és hosszú távú rendelés is.
Folyékony. Az anyagnak az az állapota, amelyben alacsony az összenyomhatósága, vagyis jól megtartja a térfogatot, de nem képes megőrizni alakját. A folyadék könnyen felveszi annak az edénynek az alakját, amelybe helyezik. A folyadék atomjai vagy molekulái az egyensúlyi állapot közelében rezegnek, más atomok zárják le, és gyakran más szabad helyekre ugrálnak. Csak rövid távú rendelés van.
Gáz. Jó összenyomhatósággal jellemezhető állapot, amelyből hiányzik a térfogat és a forma megtartásának képessége. A gáz általában elfoglalja a számára biztosított teljes térfogatot. A gáz atomjai vagy molekulái viszonylag szabadon viselkednek, a köztük lévő távolság sokkal nagyobb, mint a méretük.
Vérplazma. A plazma, amelyet gyakran az anyag aggregációs állapotának neveznek, az atomok nagy ionizációjában különbözik a gáztól. Az Univerzum barionanyagának nagy része (99,9 tömeg%-a) plazmaállapotban van.
A felületi feszültség jelensége. Felületi feszültségi együttható. hidrofil és hidrofób felületek. Szilárd test felületén lévő folyadékcsepp egyensúlyi állapota (a legkisebb energia elve). Felületaktív anyagok (surfactants) és alkalmazásuk.
A felületi feszültség a két egyensúlyi fázis közötti határfelület termodinamikai jellemzője, amelyet a határfelület egységnyi területének reverzibilis izotermokinetikus képződése határoz meg, feltéve, hogy a hőmérséklet, a rendszer térfogata és az összes komponens kémiai potenciálja mindkét fázisban megmarad. állandó.
A felületi feszültségnek kettős fizikai jelentése van: energia (termodinamikai) és erő (mechanikai). Energetikai (termodinamikai) definíció: a felületi feszültség az a fajlagos munka, amely a felületet növeli nyújtás közben, feltéve, hogy a hőmérséklet állandó. Az erő (mechanikai) definíciója: a felületi feszültség a folyadék felületét korlátozó vonal egységnyi hosszára ható erő
Felületi feszültségi együttható - a folyadék felületének 1 négyzetméterrel izotermikus növeléséhez szükséges munka.
Felületi feszültségi együttható:
- csökken a hőmérséklet emelkedésével;
- a kritikus pontban nullával egyenlő;
függ a szennyeződések jelenlététől a folyadékban.
A hidrofóbitás (más görög ὕδωρ - víz és φόβος - félelem, félelem) egy olyan molekula fizikai tulajdonsága, amely "hajlamos" elkerülni a vízzel való érintkezést. Magát a molekulát ebben az esetben hidrofóbnak nevezzük.
A hidrofilitás (más görög szóból ὕδωρ - víz és φιλία - szerelem) a testek felszínének és a vízzel való molekuláris kölcsönhatásának intenzitásának jellemzője. A hidrofóbitás mellett nemcsak azokra a testekre vonatkozik, amelyekben a felület tulajdonsága.
Tekintsük most azokat a jelenségeket, amelyek egy szilárd test felületére helyezett folyadékcseppnél jelentkeznek. Ebben az esetben három interfész van a fázisok között: gáz-folyékony, folyadék-szilárd és gáz-szilárd. A folyadékcsepp viselkedését a felületi feszültség értékei (a szabad felületi energia fajlagos értékei) határozzák meg a jelzett határfelületeken. A folyadék-gáz határfelületen fellépő felületi feszültség hatására a csepp gömb alakú lesz. Ez akkor történik meg, ha a felületi feszültség a folyadék és a szilárd anyag határfelületén nagyobb, mint a gáz és szilárd anyag határfelületén lévő felületi feszültség. Ebben az esetben a folyadékcsepp gömbbe való összehúzódási folyamata a folyadék-szilárd felület felületének csökkenéséhez vezet, miközben egyidejűleg növeli a gáz-folyadék határfelület felületét. Aztán van nem nedvesítő szilárd test felülete folyadékkal. A csepp alakját a felületi feszültség és a gravitáció eredő erői határozzák meg. Ha a csepp nagy, akkor szétterül a felületen, ha kicsi, akkor gömb alakúra hajlamos.
felületaktív anyagok ( felületaktív anyag) - kémiai vegyületek, amelyek a határfelületre koncentrálva a felületi feszültség csökkenését okozzák.
Felhasználási területek
Mosószerek. A felületaktív anyagok fő felhasználása mosó- és tisztítószerek (beleértve a fertőtlenítésre használtakat is), szappanok aktív összetevője, helyiségek, edények, ruhák, tárgyak, autók stb.
Kozmetikumok. A felületaktív anyagok fő felhasználási területe a kozmetikumokban a samponok, ahol a felületaktív anyagok tartalma elérheti a teljes térfogat több tíz százalékát.
Textilipar. A felületaktív anyagokat főként a statikus elektromosság eltávolítására használják a szintetikus szövet szálain.
bőripar. Bőrtermékek védelme az enyhe sérülésektől és letapadásoktól.
Festékipar. A felületaktív anyagokat a felületi feszültség csökkentésére használják, ami biztosítja, hogy a festékanyag könnyen behatoljon a kezelendő felület kis mélyedéseibe, és kitöltse azokat, miközben más anyagokat (például vizet) kiszorít onnan.
Papíripar. A felületaktív anyagokat a tinta és a főtt pép elkülönítésére használják a használt papír újrahasznosítása során.
Kohászat. A felületaktív emulziókat hengerművek kenésére használják. Csökkentse a súrlódást. Ellenáll a magas hőmérsékletnek, amelyen az olaj ég.
Növényvédelem. A felületaktív anyagokat széles körben használják az agronómiában és a mezőgazdaságban emulziók képzésére. A tápanyagoknak a membrán falain keresztül történő szállításának hatékonyságának növelésére szolgálnak.
Élelmiszeripar. Az ízletesség javítása érdekében emulgeálószer (pl. lecitin) formájában felületaktív anyagokat adnak hozzá.
Olajtermelés. Felületaktív anyagokat használnak az alsó lyukképződési zóna (BFZ) hidrofóbizálására az olaj visszanyerésének növelése érdekében.
Építkezés. A felületaktív anyagokat, úgynevezett lágyítószereket adják a cement-homok keverékekhez és a betonokhoz, hogy csökkentsék vízigényüket, miközben megtartják a mobilitást. Ez növeli az edzett anyag végső szilárdságát (minőségét), sűrűségét, fagyállóságát és vízállóságát.
A gyógyszer. A kationos és anionos felületaktív anyagokat a sebészetben antiszeptikumként használják.
Kapilláris jelenségek, fizikai jelenségek, amelyeket a felületi feszültség hatása nem elegyedő közegek határfelületén idéz elő. K. I.-nek. általában olyan folyékony közegben lévő jelenségeket foglalnak magukban, amelyeket felületük görbülete okoz, és amely más folyadékkal, gázzal vagy saját gőzével határos.
Nedvesedés, olyan jelenség, amely akkor következik be, amikor egy folyadék szilárd vagy más folyadék felületével érintkezik. Különösen a folyadéknak gázzal (gőzzel) vagy más folyadékkal érintkező szilárd felületen való szétterítésében, porózus testek és porok impregnálásában, a folyadék felületének a szilárd test felületéhez közeli görbületében fejeződik ki.
Laplace-képlet
Vegyünk egy vékony folyadékfilmet, amelynek vastagsága elhanyagolható. A szabad energiájának minimalizálása érdekében a film nyomáskülönbséget hoz létre a különböző oldalakról. Ez magyarázza a szappanbuborékok létezését: a film addig préselődik, amíg a buborék belsejében lévő nyomás meg nem haladja a légköri nyomást a film további nyomása. A felület egy pontjában a járulékos nyomás az adott pont átlagos görbületétől függ, és a következőképpen adja meg Laplace-képlet:
![]()
Itt R 1,2 - fő görbületi sugarak egy pontban. Ugyanolyan előjelük van, ha a megfelelő görbületi középpontok a pontban az érintősík ugyanazon az oldalán helyezkednek el, és más az előjelük, ha az ellenkező oldalon helyezkednek el. Például egy gömb esetében a görbületi középpontok a felület bármely pontján egybeesnek a gömb középpontjával, így
R 1 = R 2 = R
Egy sugarú körhenger felületének esetére R nekünk van
Vegye figyelembe, hogy Δ p folytonos függvénynek kell lennie a film felületén, hogy a film "pozitív" oldalának megválasztása egy ponton lokálisan egyedileg határozza meg a felület pozitív oldalát a hozzá elég közeli pontokon.
A Laplace-képletből az következik, hogy egy tetszőleges alakú keretre feszített, buborékokat nem képező szabad szappanfilm átlagos görbülete 0 lesz.
Molekuláris fizika és termodinamika tárgya. Statisztikai fizika és termodinamika. Az MKT gázok alapvető rendelkezései. Termodinamikai és statisztikai módszerek. A termodinamika három alapelve.
Molekuláris fizika, a fizika olyan ága, amely a testek különböző halmazállapotú fizikai tulajdonságait vizsgálja mikroszkopikus (molekula) szerkezetük figyelembevételével.
Termodinamika, a termodinamikai egyensúlyi állapotban lévő makroszkopikus rendszerek legáltalánosabb tulajdonságainak és ezen állapotok közötti átmenet folyamatainak tudománya.
statisztikai fizika, a fizika olyan ága, amelynek feladata a makroszkopikus testek, vagyis nagyon sok azonos részecskékből (molekulák, atomok, elektronok stb.) álló rendszerek tulajdonságainak kifejezése e részecskék tulajdonságain és a köztük lévő kölcsönhatáson keresztül .
Molekuláris kinetikai elmélet az a doktrína, amely a testek szerkezetét és tulajdonságait a testeket alkotó atomok, molekulák és ionok mozgásával és kölcsönhatásával magyarázza.
Az anyag MKT szerkezetének középpontjában az áll három pozíciót, melyek mindegyike megfigyelések és kísérletek segítségével bizonyított (Brown-mozgás, diffúzió stb.):
1.
az anyag részecskékből áll;
2.
a részecskék véletlenszerűen mozognak;
3.
a részecskék kölcsönhatásba lépnek egymással.
A molekuláris kinetikai elmélet célja a makroszkopikus testek tulajdonságainak és a bennük végbemenő termikus folyamatoknak a magyarázata, abból a felfogásból, hogy minden test különálló, véletlenszerűen mozgó részecskékből áll.
A molekuláris fizika által vizsgált folyamatok hatalmas számú molekula együttes hatásának az eredménye. Hatalmas számú molekula viselkedési törvényszerűségeit, lévén statisztikai törvényszerűségek, segítségével tanulmányozzuk statisztikai módszer. Ez a módszer azon alapul, hogy a makroszkopikus rendszer tulajdonságait végső soron a rendszer részecskéinek tulajdonságai, mozgásuk, ill. átlagolva ezen részecskék dinamikus jellemzőinek értékei (sebesség, energia stb.). Például egy test hőmérsékletét a molekulái kaotikus mozgásának sebessége határozza meg, de mivel az idő bármely pillanatában a különböző molekulák különböző sebességűek, ez csak a molekulák sebességének átlagértékén keresztül fejezhető ki.
A termodinamika nem veszi figyelembe azokat a mikrofolyamatokat, amelyek ezen átalakulások hátterében állnak. Ez termodinamikai módszer különbözik a statisztikáktól. A termodinamika két alapvető törvényen alapul, amelyek a kísérleti adatok általánosítása eredményeként jöttek létre.
A termodinamika alapelvei- a termodinamika alapjául szolgáló posztulátumok halmaza. Ezeket a rendelkezéseket tudományos kutatás eredményeként határozták meg, és kísérletileg igazolták. Ezeket posztulátumokként fogadják el, hogy a termodinamika axiomatikusan megszerkeszthető legyen.
A termodinamikai alapelvek szükségessége összefügg azzal a ténnyel, hogy a termodinamika a rendszerek makroszkopikus paramétereit írja le anélkül, hogy konkrét feltételezéseket tenne azok mikroszkópos szerkezetére vonatkozóan. A statisztikai fizika a belső szerkezet kérdéseivel foglalkozik.
A termodinamika törvényei függetlenek, azaz egyik sem vezethető le más elvekből.
A termodinamika első főtétele
A rendszer által kapott hőmennyiség belső energiájának megváltoztatására és külső erőkkel szembeni munkára szolgál.
A rendszer belső energiájának változása az egyik állapotból a másikba való átmenet során egyenlő a külső erők munkájának és a rendszerbe átvitt hőmennyiség összegével, és nem függ attól, hogy ez az átmenet milyen módszerrel történik. ki.
δ K = δ A + dU , ahol dU a rendszer belső energiájának teljes differenciája, és δ Kés δ A a rendszernek átadott elemi hőmennyiség és a rendszer által végzett elemi munka, ill.
A termodinamika második főtétele
A termodinamika második főtétele kizárja a második típusú örökmozgó létrehozásának lehetőségét.
1 - Clausius posztulátuma. Nincs olyan folyamat, amelynek egyetlen eredménye a hő átadása egy hidegebb testről a melegebbre.
2 - Kelvin posztulátuma. Lehetetlen egy körkörös folyamat, amelynek egyetlen eredménye a termikus tározó hűtésével végzett munka lenne.
A termodinamika harmadik főtétele a következőképpen fogalmazható meg:
entrópia növekmény ( a rendszer zavarának mértékeként) abszolút nullánál a hőmérséklet egy véges határra hajlik, függetlenül a rendszer egyensúlyi állapotától.
A termodinamika nulla kezdete (a termodinamika általános törvénye)
Az a fizikai alapelv, hogy egy izolált rendszer kezdeti állapotától függetlenül végül termodinamikai egyensúly jön létre benne, és az is, hogy a termodinamikai egyensúly elérésekor a rendszer minden részének hőmérséklete azonos lesz. Így a nulla elv tulajdonképpen bevezeti és meghatározza a hőmérséklet fogalmát. A nulla indítás egy kicsit szigorúbb formát adhat:
Ha a rendszer A termodinamikai egyensúlyban van a rendszerrel B, és ez viszont a rendszerrel C, majd a rendszer A egyensúlyban van vele C. A hőmérsékletük azonban egyenlő.
Az FFWikiről.
| Tantárgy | Termodinamika és statisztikai fizika | Szemeszter | 7-8 | Típusú | előadás, szeminárium | Jelentés | vizsga | Szék | Kvantumstatisztikai és térelméleti tanszék |
|---|
A témáról
Termodinamika és statisztikai fizika. Az első kérdés, amikor ezt a témát látja az órarendben: hogyan? Valóban, az 1. évben már a molekuláris fizikáról beszéltek, ahol a termodinamika mind a 3 alapelve, és a potenciálok, valamint a Maxwell-eloszlás megvolt. Úgy tűnik, mi más lehet új a természetben?
Kiderült, hogy ami az 1. tanfolyamon volt, az bababeszélgetés a valódi termodinamikához és a statisztikai fizikához képest. Az, amellyel Landau folyékony héliumot számolt, és megkapta a Nobel-díjat.
Fontos, hogy ne keveredj bele, arra gondolva, hogy 1 előadáson egyszer elmondják, amit az iskolában tudtál, akkor ez továbbra is így lesz. Szeptember közepétől már elképesztő trükköknek lehetsz szemtanúja a parciális deriváltokkal, az őszi félév végére pedig a statisztikai fizika nagyon dühös témái mennek majd:
- Statisztikai összegek és Gibbs-eloszlások számítása
- Kvantumgázok - Fermi és Bose gázok különböző feltételekkel
- Fázisátmenetek és tulajdonságaik
- Nem ideális gázok - Bogolyubov láncok, plazma és elektrolit modellek
Bár ezeknek a szavaknak a írója 4 nappal a vizsgák előtt kitűnőre tudott készülni, ezt nagyon megbánja, és senkinek sem tanácsolja, hogy ilyen erőszakot ismételjen meg az agya ellen :) A vizsga feladatai és kérdései az év elején, és nagyon hasznos az anyag egy részét előre elkészíteni.
A tavaszi félévben vannak könnyű és nehéz témák egyaránt. Például a Brown-mozgás elmélete meglehetősen könnyen kiírható. De a kurzus végén különféle kinetikai egyenletek vannak, amelyeket sokkal nehezebb kezelni.
Vizsga
Az őszi vizsga elég jól megy, nem nagyon adnak leírnivalót. A tanárok nagyrészt nem hoznak le, de különösebb ajándékokat sem vettek észre. Ismerned kell az elméletet. Az oklevél tartalmaz egy értékelést a tavaszi vizsgára. A tavaszi vizsga nehezebb, mint az őszi, de általában lojálisabban fogadják. Az elméletet azonban jól ismerni kell.
A jegyben ősszel és tavasszal is 2 elméleti kérdés és egy feladat található.
Legyen óvatos a statisztikával, több ember (a szám 2-től 10-ig változik!) Rendszeresen érettségizz úgy, hogy megbukik ezen a vizsgán. És nem akárkiről van szó, hanem edzett negyedikes hallgatókról.
anyagokat
Őszi szemeszter
- Tájékoztató 7 félév (pdf) - hasznos szórólap
- Válaszok termodinamikával kapcsolatos kérdésekre (pdf) - jegyenként 1 kérdés
- Válaszok a statisztikai fizikával kapcsolatos kérdésekre (pdf) - 2 kérdés a jegyben
- https://vk.com/doc231234703_450962027?hash=b2eb6c2220f95a7795&dl=cf7b5295f12e0fd4e0 feladatok az első kollokviumra
- https://vk.com/doc181113102_453848269?hash=6d6f68abc3358e2adf&dl=1606060abdd44d226e a másodikra
Tavaszi szemeszter
- Válaszok a vizsgakérdésekre, elmélet (pdf) - válaszok a vizsga elméleti kérdéseire, szépen gépelve számítógépen.
- - problémamegoldás
- Problémamegoldás a vizsgára (pdf) - több problémamegoldás
Irodalom
problémás könyvek
- Termodinamika és statisztikus fizika feladatok a Moszkvai Állami Egyetem Fizikai Karának 4. éves hallgatói számára (őszi szemeszter - egyensúlyi rendszerek elmélete) (pdf)
2. előadás
Termodinamika, statisztikai fizika, információs entrópia
1. Információk a termodinamikából és a statisztikus fizikából. elosztási függvény. Liouville tétele. Mikrokanonikus eloszlás. A termodinamika első főtétele. adiabatikus folyamatok. Entrópia. statisztikai súly. Boltzmann-képlet. A termodinamika második főtétele. Reverzibilis és irreverzibilis folyamatok.
2. Shannon információs entrópia. Bitek, natsok, tökfejek stb. Az entrópia és az információ kapcsolata.
Ez a rész az 1. előadáshoz tartozik. Érdemesebb az V. részben („A kvantumállapotok összefonódásának fogalma”) foglalkozni.
A LE CNOT így van ábrázolva:
A (ku) a bit értékét tároljuk, míg a (ku) b bit az XOR törvény szerint változik:
bit b(cél = cél) akkor és csak akkor változtatja meg az állapotát, ha a vezérlőbit állapota a 1-nek felel meg; ebben az esetben a vezérlőbit állapota nem változik.
A logikai XOR művelet (CNOT) szemlélteti, hogy a klasszikus adatokat miért lehet klónozni, de a kvantumadatokat miért nem. Megjegyezzük, hogy általános esetben kvantumadatok alatt az alak szuperpozícióit értjük
![]() , (1)
, (1)
ahol és vannak komplex számok vagy állapotamplitúdók, sőt, .
Az igazságtáblázat szerint, ha az XOR-t olyan logikai adatokra alkalmazzuk, amelyekben a második bit „0” állapotban van (b), és az első bit „X” állapotban van (a), akkor az első bit nem megváltozott, a második pedig annak másolata lesz:
U XOR (X, 0) = (X, X), ahol X = „0” vagy „1”.
Kvantum esetben az (1) szuperpozíciót az „X” szimbólummal jelölt adatnak kell tekinteni:
![]() .
.
Fizikailag az adatok kódolhatók például a |V> = 1, |H> = 0 (H,V)= (0,1) polarizációs bázisban:
![]() és
és ![]()
Látható, hogy valóban megtörténik az állammásolás. A klónozás tilalma tétele kimondja, hogy a másolás lehetetlen. tetszőleges kvantumállapot. A vizsgált példában a másolásra azért került sor, mert a műveletet saját bázison (|0>, |1>) hajtották végre, pl. ban ben magán kvantumállapot esete.
Úgy tűnik, hogy az XOR művelet két logikai állapot szuperpozíciójának másolására is használható, például |45 0 > ? |V> + |H>:
![]()
De nem az! A kvantumevolúció egysége megköveteli, hogy a bemeneti állapotok szuperpozíciója a kimeneti állapotok megfelelő szuperpozíciójává alakuljon át:
![]() (2)
(2)
Ez az ún. összefonódott állapot (Ф+), amelyben a két kimeneti qubitnek nincs meghatározott értéke (jelen esetben polarizáció). Ez a példa azt mutatja, hogy a kvantumobjektumokkal végzett logikai műveletek más szabályokat követnek, mint a klasszikus számítási folyamatokban.
Felmerül a következő kérdés: Kimeneti módban lévő állapotnak tűnik a ismét szuperpozícióként ábrázolható ![]() mint a legkorszerűbb b. Hogyan mutassuk meg, hogy ez nem így van, vagyis hogy egyáltalán nincs értelme a mód (bit) állapotairól beszélni? aés modok (bit) b?
mint a legkorszerűbb b. Hogyan mutassuk meg, hogy ez nem így van, vagyis hogy egyáltalán nincs értelme a mód (bit) állapotairól beszélni? aés modok (bit) b?
Használjuk a polarizációs analógiát amikor
![]() (3).
(3).
Két módja van. Az 1. út hosszú, de következetesebb. Mindkét kimeneti módhoz ki kell számítani a Stokes-paraméterek átlagos értékét. Az átlagokat a (2) hullámfüggvény veszi át. Ha mindegyik nullának bizonyul, akkor ez az állapot polarizálatlan, azaz. kevert és a szuperpozíciónak (3) nincs jelentése. A Heisenberg-reprezentációban dolgozunk, amikor az operátorok transzformálva vannak, de a hullámfüggvény nem.
Szóval megtaláljuk a divatban a.
![]() a teljes sugárintenzitás a,
a teljes sugárintenzitás a,
![]() - a függőleges polarizáció aránya,
- a függőleges polarizáció aránya,
![]() - +45 0. polarizáció megosztása,
- +45 0. polarizáció megosztása,
![]() - a jobb-kör polarizáció aránya.
- a jobb-kör polarizáció aránya.
A hullámfüggvény, amelyen az átlagolás történik, a következő formában jelenik meg: (2):
hol vannak a születés és halál operátorai a modokban aés b szabályok szerint működik:

(Számításokat végezzen az V. részben (lásd a jegyzetfüzetet). Ugyanitt számítsa ki az egybeesések regisztrálásának valószínűségét vagy az űrlap korrelátorát ![]() }
}
II. út – vizuálisabb, de kevésbé „őszinte”!
Határozzuk meg a fényintenzitás függését a módusban a az ebbe a módba helyezett polaroid forgásszögén. Ez a standard kvantum-optikai módszer az állapot ellenőrzésére (2) – az intenzitás nem függhet a forgástól. Ugyanakkor az egybeesések számának hasonló függősége van
![]() . Először E. Fry (1976) és A. Aspek (1985) kapott ilyen függőséget, és gyakran a kvantummechanika nem lokalitásának bizonyítékaként értelmezik.
. Először E. Fry (1976) és A. Aspek (1985) kapott ilyen függőséget, és gyakran a kvantummechanika nem lokalitásának bizonyítékaként értelmezik.
Tehát a kísérleti helyzet az ábrán látható:

Definíció szerint
![]()
hol van a megsemmisítési operátor az a módban. Ismeretes, hogy a két ortogonálisan polarizált x és y módus operátorainak transzformációja, amikor a fény egy szögben orientált polaroidon halad át, a következőképpen alakul:
![]() .
.
(csak az első, negyedik, ötödik és nyolcadik tag nem nulla) =
(csak az első és a nyolcadik tag különbözik a nullától) = - nem függ a szögtől?!
Fizikailag ez azért történik, mert a (2) hullámfüggvény nincs faktorizálva, és nincs értelme az üzemmódokban lévő állapotokról beszélni. aés b külön. Így nem vitatható, hogy az a módus szuperpozíciós állapotban van (3)!
Megjegyzés. Az elvégzett számítások (II. út) egyáltalán nem igazolják, hogy az állam divatos. a polarizálatlan. Például körkörösen polarizált fény jelenlétében ebben az üzemmódban az eredmény ugyanaz lenne. Szigorú bizonyítás – például Stokes-paramétereken keresztül (V. szakaszban).
Vegyük észre, hogy ugyanígy eljárva bebizonyíthatjuk, hogy a CNOT elem előtti a módusban lévő állapot polarizált.

Itt az átlagolást a kiindulási állapot hullámfüggvényén (3) kell elvégezni. Az eredmény a következő:
![]() azok. a maximális értékeket = 45 0 értéknél érjük el.
azok. a maximális értékeket = 45 0 értéknél érjük el.
Információ és entrópia.
Anélkül, hogy még bevezetnénk az „operatív” „információ” kifejezést, a „mindennapi” nyelvhasználattal fogunk érvelni. Azok. az információ bizonyos tudás egy tárgyról.
A következő példa arról beszél, hogy az információ és az entrópia fogalma szorosan összefügg. Tekintsünk egy ideális gázt termodinamikai egyensúlyban. Egy gáz nagyszámú molekulából áll, amelyek V térfogatban mozognak. Az állapotparaméterek a nyomás és a hőmérséklet. Egy ilyen rendszer állapotainak száma óriási. A gázentrópia a TD egyensúlyban maximális, és amint a Boltzmann-képletből következik, a rendszer mikroállapotainak száma határozza meg. Arról ugyanakkor semmit nem tudunk, hogy adott időpontban milyen konkrét állapotú a rendszer, nincs is - az információ minimális. Tegyük fel, hogy valahogyan egy nagyon gyors műszer segítségével sikerült „bekukucskálnunk a rendszer állapotába egy adott pillanatban. Szóval kaptunk néhány információt róla. Akár azt is el lehet képzelni, hogy nemcsak a molekulák koordinátáit, hanem a sebességüket is lefotóztuk (például több fényképet egymás után). Ugyanakkor minden pillanatban, amikor a rendszer állapotáról információ áll rendelkezésünkre, az entrópia nullára hajlik, mivel a rendszer csak egy meghatározott állapotban van a hatalmas változatosságuk közül, és ez az állapot erősen nem egyensúlyi. Ez a példa azt mutatja, hogy az információ és az entrópia valóban valamilyen módon összefügg, és a kapcsolat jellege már kirajzolódik: minél több információ, annál kevesebb entrópia.
Információk a termodinamikából és a statisztikus fizikából.
A testek (sok molekula) makroszkopikus állapotát jellemző fizikai mennyiségeket termodinamikainak nevezzük (beleértve az energiát, a térfogatot). Vannak azonban olyan mennyiségek, amelyek pusztán statisztikai törvényszerűségek hatására jelennek meg, és amelyeknek csak makroszkopikus rendszerekre alkalmazva van értelme. Ilyen például az entrópia és a hőmérséklet.
klasszikus statisztika
*Liouville tétele. Az eloszlásfüggvény állandó az alrendszer fázispályái mentén (kvázi zárt alrendszerekről beszélünk, így a tétel csak nem túl hosszú időintervallumokra érvényes, amelyek során az alrendszer zártként viselkedik).

Itt - - eloszlásfüggvény vagy valószínűségi sűrűség. A valószínűségen keresztül vezetik be w észleli az alrendszert a fázistér elemben ebben az időpontban: dw = ( p 1 ,..., ps , q 1 ,..., qs ) dpdq , és
Bármely alrendszer statisztikai eloszlásának megtalálása a statisztika fő feladata. Ha a statisztikai eloszlás ismert, akkor lehetséges bármilyen fizikai mennyiség különböző értékeinek valószínűségét kiszámítani az alrendszer állapotától függően (azaz a koordináták és a nyomatékok értékétől):
![]() .
.
*Mikrokanonikus eloszlás.
Az eloszlás két alrendszer összességére (ezeket zártnak, azaz gyengén kölcsönhatónak feltételezzük) egyenlő. Ezért ![]() - az eloszlásfüggvény logaritmusa - nagysága adalékanyag. Liouville tételéből következik, hogy az eloszlásfüggvényt a p és q változók olyan kombinációival kell kifejezni, amelyeknek állandónak kell maradniuk az alrendszer zártként történő mozgása során (az ilyen mennyiségeket mozgásintegráloknak nevezzük). Ez azt jelenti, hogy az eloszlásfüggvény maga a mozgás integrálja. Sőt, logaritmusa is a mozgás integrálja, és adalékanyag. Összesen hét mozgásintegrál van a mechanikában - energia, három impulzus- és három szögimpulzus - (az a alrendszer esetében: E a (p,
q),
P
a (p,
q), M a (p,
q)). Ezen mennyiségek egyetlen additív kombinációja az
- az eloszlásfüggvény logaritmusa - nagysága adalékanyag. Liouville tételéből következik, hogy az eloszlásfüggvényt a p és q változók olyan kombinációival kell kifejezni, amelyeknek állandónak kell maradniuk az alrendszer zártként történő mozgása során (az ilyen mennyiségeket mozgásintegráloknak nevezzük). Ez azt jelenti, hogy az eloszlásfüggvény maga a mozgás integrálja. Sőt, logaritmusa is a mozgás integrálja, és adalékanyag. Összesen hét mozgásintegrál van a mechanikában - energia, három impulzus- és három szögimpulzus - (az a alrendszer esetében: E a (p,
q),
P
a (p,
q), M a (p,
q)). Ezen mennyiségek egyetlen additív kombinációja az
továbbá az együtthatóknak (hét van) egy adott zárt rendszer összes alrendszerére azonosnak kell maradniuk, és a normalizálási feltételek közül (4) kell kiválasztani.
A (4) normalizálási feltétel teljesüléséhez szükséges, hogy a függvény (p, q) pontokban foglalkozik E 0, R 0, M 0 a végtelenig. Egy pontosabb megfogalmazás adja a kifejezést
Mikrokanonikus eloszlás.
A - függvények jelenléte biztosítja az eltűnést a fázistér minden olyan pontjára, ahol a mennyiségek legalább egyike E, R, M nem egyenlő a megadott (átlagos) értékével E 0, R 0, M 0 .
Hat integrálból P és M ártalmatlanítható úgy, hogy a rendszert tömör dobozba zárja, amelyben az áll.
![]() .
.
Fizikai entrópia
Ismét az ideális gáz fogalmát használjuk.
Legyen egy monoatomi ideális gáz sűrűséggel nés hőmérséklet T kötetet foglal el V. A hőmérsékletet energiaegységekben mérjük - a Boltzmann-állandó nem jelenik meg. Minden gázatom átlagos hőmozgási energiával egyenlő 3T/2. Ezért a gáz teljes hőenergiája az
Ismeretes, hogy a gáznyomás az p = nt. Ha a gáz hőt cserélhet a környezettel, akkor a gáz energiamegmaradási törvénye így néz ki:
![]() . (5)
. (5)
Így a gáz belső energiájában változás történhet mind az általa végzett munkának, mind pedig egy bizonyos mennyiségű hő befogadásának köszönhetően. dQ kívülről. Ez az egyenlet fejezi ki a termodinamika első főtételét, azaz. energiamegmaradás törvénye. Feltételezzük, hogy a gáz egyensúlyban van, azaz. p = const az egész kötetben.
Ha feltételezzük, hogy a gáz is TD egyensúlyi állapotban van, T =const, akkor az (5) összefüggés a gázparaméterek elemi változási folyamatának tekinthető azok nagyon lassú változása során, amikor a TD egyensúly nem bomlik. Az ilyen folyamatokhoz vezetjük be az S entrópia fogalmát a reláció segítségével
Így azt állítják, hogy a belső energián kívül az egyensúlyi gáznak van még egy belső jellemzője, amely az atomok hőmozgásához kapcsolódik. Az (5, 6) szerint állandó térfogaton dV= 0, az energia változása arányos a hőmérséklet változásával, és általános esetben
![]()
Mert ![]() ahol N =
nV =
const a gázatomok teljes száma, akkor az utolsó reláció így írható fel
ahol N =
nV =
const a gázatomok teljes száma, akkor az utolsó reláció így írható fel
![]()
Az integráció után megkapjuk

A szögletes zárójelben lévő kifejezés a részecskénkénti entrópia.
Így ha a hőmérséklet és a térfogat is úgy változik, hogy VT 3/2 állandó marad, akkor az S entrópia nem változik. A (6) szerint ez azt jelenti, hogy a gáz nem cserél hőt a környezettel, azaz. a gázt hőszigetelő falak választják el tőle. Az ilyen folyamatot ún adiabatikus.
Mert a
ahol = 5/3 adiabatikus kitevőnek nevezzük. Így egy adiabatikus folyamatban a hőmérséklet és a nyomás a sűrűséggel a törvény szerint változik
Boltzmann-képlet
Amint Liouville tételéből következik, az eloszlásfüggvény? éles maximuma van E = E 0-nál (átlagérték), és csak ennek a pontnak a közelében nem nulla. Ha megadja a görbe E szélességét (E), definiálva azt egy olyan téglalap szélességeként, amelynek magassága megegyezik az (E) függvény értékével a maximális pontban, és a területe egy ![]() (megfelelő normalizálással). Az energiaértékek tartományából át lehet lépni a Γ állapotok számába az E-hez tartozó energiákkal (ez tulajdonképpen a rendszer energiájának átlagos ingadozása). Ekkor a Γ mennyiség azt jellemzi, hogy a rendszer makroszkopikus állapota milyen mértékben oszlik el a mikroszkopikus állapotai között. Más szóval, klasszikus rendszerek esetén Г a fázistér azon tartományának a mérete, amelyben az adott alrendszer szinte minden idejét eltölti A fázistérnek van egy térfogatú cellája, ahol s a szabadsági fokok száma
(megfelelő normalizálással). Az energiaértékek tartományából át lehet lépni a Γ állapotok számába az E-hez tartozó energiákkal (ez tulajdonképpen a rendszer energiájának átlagos ingadozása). Ekkor a Γ mennyiség azt jellemzi, hogy a rendszer makroszkopikus állapota milyen mértékben oszlik el a mikroszkopikus állapotai között. Más szóval, klasszikus rendszerek esetén Г a fázistér azon tartományának a mérete, amelyben az adott alrendszer szinte minden idejét eltölti A fázistérnek van egy térfogatú cellája, ahol s a szabadsági fokok száma
A Г értékét a makroszkopikus állapot statisztikai súlyának nevezzük, így írható fel:
A statisztikai súly logaritmusát entrópiának nevezzük:
ahol - statisztikai súly = a rendszer vizsgált makroállapota által lefedett mikroállapotok száma.
![]() .
.
A kvantumstatisztika azt mutatja, hogy = 1. Ekkor
Ahol a statisztikai mátrixot (sűrűséget) értjük. Tekintettel az energiaeloszlási függvény (*) logaritmusának linearitására, ahol az átlagolást az eloszlási függvényen hajtjuk végre.
Mivel az állapotok száma semmi esetre sem kisebb egynél, az entrópia nem lehet negatív. S egy makroszkopikus rendszer energiaspektrumának szintek sűrűségét határozza meg. Az entrópia additivitását tekintve elmondható, hogy egy makroszkopikus test szintjei közötti átlagos távolságok exponenciálisan csökkennek a méretének (vagyis a benne lévő részecskék számának) növekedésével. Az entrópia legmagasabb értéke a teljes statisztikai egyensúlynak felel meg.
A rendszer egyes makroszkopikus állapotait a különböző alrendszerek közötti energiaeloszlással jellemezve azt mondhatjuk, hogy a rendszer által egymás után áthaladó állapotok száma egyre valószínűbb energiaeloszlásnak felel meg. Ez a valószínűségnövekedés exponenciális jellege miatt nagy. e S- a kitevőben van egy additív érték - entrópia. Hogy. a nem egyensúlyi zárt rendszerben lezajló folyamatok úgy mennek végbe, hogy a rendszer folyamatosan halad át az alacsonyabb entrópiájú állapotokból a magasabb entrópiájú állapotokba. Ennek eredményeként az entrópia eléri a lehető legmagasabb értéket, ami megfelel a teljes statisztikai egyensúlynak.
Így, ha egy zárt rendszer egy adott időpontban nem egyensúlyi makroszkopikus állapotban van, akkor a következő időpontokban a legvalószínűbb következmény a rendszer entrópiájának monoton növekedése lesz. Ez- termodinamika második főtétele (R. Clausius, 1865). Statisztikai indoklását Boltzmann L. adta meg 1870-ben. Más meghatározás:
ha egy zárt rendszer entrópiája egy adott időpontban eltér a maximumtól, akkor a következő pillanatokban az entrópia nem csökken. Növekszik, vagy korlátozó esetben állandó marad. E két lehetőség szerint a makroszkopikus testekkel végbemenő összes folyamatot általában fel kell osztani visszafordíthatatlan és megfordítható . visszafordíthatatlan - azok a folyamatok, amelyek az egész zárt rendszer entrópiájának növekedésével járnak (nem fordulhatnak elő olyan folyamatok, amelyek fordított sorrendben ismétlődnek, mivel ebben az esetben az entrópiának csökkennie kellene). Vegye figyelembe, hogy az entrópia csökkenését ingadozások okozhatják. megfordítható Olyan folyamatokat nevezünk, amelyekben egy zárt rendszer entrópiája állandó marad, és amelyek ezért ellenkező irányban is lejátszódhatnak. A szigorúan visszafordítható folyamat ideális korlátozó eset.
Az adiabatikus folyamatok során a rendszer nem vesz fel és nem bocsát ki hőt. ? K = 0 .
Megjegyzés: (alapvető). Az az állítás, hogy egy zárt rendszernek kellően hosszú ideig (a relaxációs időnél tovább) egyensúlyi állapotba kell kerülnie, csak olyan rendszerre vonatkozik, amely stacionárius külső körülmények között van. Példa erre az Univerzum egy nagy, megfigyelésünk által hozzáférhető régiójának viselkedése (a természet tulajdonságainak semmi köze egy egyensúlyi rendszer tulajdonságaihoz).
Információ.
Vegyünk egy cellákra osztott szalagot - egy klasszikus regiszter. Ha a két karakter közül csak egy helyezhető el minden cellában, akkor azt mondják, hogy a cella egy kis információt tartalmaz. Nyilvánvaló (lásd az 1. előadást), hogy a tartalmazó regiszterben N sejtek tartalmaznak N egy kis információ, és meg lehet írni 2 Nüzenetek. Tehát az információs entrópiát bitekben mérjük:
![]() (7)
(7)
Itt Q N = 2 N a különböző üzenetek teljes száma. A (7)-ből világos, hogy Az információs entrópia egyszerűen egyenlő a bizonyos információk rögzítésére használható bináris cellák minimális számával.
A (7) definíció másképpen is átírható. Legyen nekünk sok Q N különféle üzenetek. Határozzuk meg annak valószínűségét, hogy a szükséges üzenet megegyezik a teljes számból véletlenszerűen kiválasztott üzenettel Q N különféle üzenetek. Nyilvánvalóan egyenlő P N = 1/ Q N. Ekkor a (7) definíció a következőképpen írható fel:
![]() (8)
(8)
Minél több sejt N, annál kevésbé valószínű P Nés minél nagyobb az információs entrópia H B ebben az üzenetben.
Példa . Az ábécé betűinek száma 32 (ё nélkül). A 32 szám két 32 = 2 5 ötödik hatványa. Ahhoz, hogy az egyes betűket bináris számok egy bizonyos kombinációjával illessze, 5 cellával kell rendelkeznie. A kisbetűkhöz nagybetűket adva megduplázzuk a kódolni kívánt karakterek számát - 64 = 2 6 lesz -, azaz. plusz információ hozzáadva H B= 6. Itt H B- az információ mennyisége betűnként (kis- vagy nagybetű). Az információs entrópia ilyen közvetlen kiszámítása azonban nem teljesen pontos, mivel az ábécében vannak olyan betűk, amelyek ritkábban vagy gyakrabban fordulnak elő. A ritkábban előforduló betűknek nagyobb számú cellát adhatunk, és a gyakran előforduló betűkhöz mentsük el és adjuk meg azokat a regiszterállapotokat, amelyek kevesebb cellát foglalnak el. Az információs entrópia pontos meghatározását Shannon adta meg:
![]() (9)
(9)
Formálisan ennek az összefüggésnek a levezetése a következőképpen igazolható.
Fentebb megmutattuk
az eloszlásfüggvény logaritmusának additivitása és energiabeli linearitása miatt.
Hadd p- valamilyen diszkrét f i érték eloszlásfüggvénye (például az „o” betű ebben a szövegben). Ha a funkciót használja p felépíteni egy valószínűség-eloszlási függvényt a mennyiség különböző értékeiről f = f 1 , f 2 ,... fN, akkor ennek a függvénynek a maximuma , ahol és (normalizálás) lesz. Ekkor p()= 1 és (általában ez igaz a (*) feltételt kielégítő függvényosztályra)
Az összegzés az összes szimbólumon (az ábécé betűi) és a pi egy számmal rendelkező szimbólum előfordulási valószínűségét jelenti én. Amint láthatja, ez a kifejezés a gyakran használt betűket és azokat a betűket is magában foglalja, amelyek valószínűleg nem jelennek meg egy adott üzenetben.
Mivel a (9) kifejezésben a természetes logaritmus szerepel, a megfelelő információegységet „nat”-nak nevezzük.
A (9) kifejezés átírható
ahol a zárójelek a szokásos klasszikus átlagolást jelentik a p i eloszlásfüggvény segítségével.
Megjegyzés . A következő előadásokban azt mutatjuk be, hogy a kvantumállapotokra
hol van a sűrűségmátrix. Formálisan a (10) és (11) kifejezések egybeesnek, de van egy jelentős különbség is. A klasszikus átlagolást a rendszer ortogonális (saját) állapotai felett végezzük, míg a kvantumeseteknél az állapotok lehetnek nem ortogonálisak is (szuperpozíciók). Ezért mindig H quant H osztály !
A (8) és (9) képlet különböző bázisú logaritmusokat használ. A (8)-ban - 2-es, a (9)-ben - e-es bázissal Az ezeknek a képleteknek megfelelő információs entrópiák könnyen kifejezhetők egymáson keresztül. Azt a relációt használjuk, amelyben M tetszőleges szám
![]() .
.
Akkor ezt figyelembe véve ![]() és megkapjuk
és megkapjuk
![]() - a bitek száma közel másfélszerese a natoknak!
- a bitek száma közel másfélszerese a natoknak!
Hasonlóan érvelve megkaphatjuk a tritekben és bitekben kifejezett entrópiák arányát:
A számítástechnikában az információt bináris bázisban (bitekben) használják. A fizikában való érveléshez kényelmesebb Shannon (nats-ban) szerinti információkat használni, amelyek bármilyen diszkrét információt jellemezhetnek. Mindig megtalálhatja a megfelelő bitek számát.
AZ ENTRÓPIA ÉS INFORMÁCIÓ KAPCSOLATA. Maxwell démona
Ezt a paradoxont először Maxwell vette figyelembe 1871-ben (lásd 1. ábra). Hagyjon valamilyen "természetfeletti" erőt kinyitni és bezárni a csappantyút egy két részre tagolt és gázt tartalmazó edényben. A redőny a szabály szerint van vezérelve: akkor nyílik ki, ha gyors, jobbról balra mozgó molekulák érintik, vagy ha lassú molekulák érik el az ellenkező irányba haladva. Így a démon munka nélkül bevezeti a két térfogat közötti hőmérsékletkülönbséget, ami sérti a termodinamika második főtételét.

Maxwell démon. A démon a nyomáskülönbséget úgy állítja be, hogy kinyitja a csappantyút, amikor a bal oldalról érkező gázmolekulák száma meghaladja a jobb oldali ütközések számát. Ez teljesen visszafordítható módon megtehető, mindaddig, amíg a molekulákra vonatkozó megfigyeléseinek véletlenszerű eredményeit a démon memóriája tárolja. Ezért a démon memóriája (vagy feje) felforrósodik. A visszafordíthatatlan lépés nem az információ felhalmozódása, hanem az információ elveszik, amikor a démon törli a memóriát. Fent: A démon memóriájának információbitekkel való feltöltése véletlenszerű folyamat. A pontozott vonaltól jobbra egy üres memóriaterület (minden cella 0 állapotban van, balra véletlenszerű bitek). Lent egy démon.
Számos kísérlet történt a paradoxon feloldására vagy a démon kiűzésére. Például azt feltételezték, hogy a démon nem tud információt kinyerni munkavégzés vagy a gáz megzavarása (vagyis felmelegítése) nélkül – de kiderült, hogy ez nem így van! Más próbálkozások odáig fajultak, hogy a második alapelv megsérthető néhány „ésszerű” vagy „gondolkodó” erő (lény) hatására. 1929-ben Szilárd Leó jelentősen "előre vitte" a probléma megoldását, minimális megfogalmazásra redukálva és kiemelve a lényeges összetevőket. A legfontosabb dolog, amit a démonnak meg kell tennie, hogy megállapítsa, hogy a tolózártól jobbra vagy balra van-e egyetlen molekula, amely lehetővé tenné a hő kinyerését. Egy ilyen eszközt Szilard motornak hívtak. Szilárd azonban nem oldotta fel a paradoxont, mert elemzése nem vette figyelembe, hogy az a mérés, amely alapján a démon tudja, hogy a molekula a jobb vagy a bal oldalon van, hogyan befolyásolja az entrópia növekedését (lásd Szilard_demon.pdf ábra). A motor hatlépéses ciklusban működik. A motor egy henger, amelynek végein dugattyúk vannak elhelyezve. Középen csillapító van behelyezve. A septumban való lökdösődés munkája nullára csökkenthető (ezt Szilárd mutatta meg). Van egy memóriaeszköz is (UP). Három állapot egyikében lehet. "Üres", "Molekula a jobb oldalon" és "Molekula a bal oldalon". Kiindulási állapot: BP = „Üres”, a dugattyúk lenyomva, a partíció kinyújtva, a molekula átlagos sebességgel rendelkezik, amelyet a termosztát hőmérséklete határoz meg (1. dia).
1. A septumot behelyezzük úgy, hogy a molekula a jobb vagy bal oldalon marad (2. dia).
2. A memóriaeszköz meghatározza, hol van a molekula, és „jobb” vagy „bal” állapotba kerül.
3. Tömörítés. Az UE állapotától függően a dugattyút arról az oldalról tolják be, ahol nincs molekula. Ez a lépés nem igényel semmilyen munkát. Mivel a vákuum össze van nyomva (3. dia).
4. A partíció eltávolításra kerül. A molekula nyomást kezd kifejteni a dugattyúra (4. dia).
5. Munkalöket. A molekula nekiütközik a dugattyúnak, amitől az ellenkező irányba mozog. A molekula energiája átadódik a dugattyúnak. Ahogy a dugattyú mozog, az átlagos sebességének csökkennie kell. Ez azonban nem történik meg, mivel az edény falai állandó hőmérsékletűek. Ezért a termosztát hője átadódik a molekulának, állandó sebességgel. Így a munkalöket során a termosztát által szolgáltatott hőenergia a dugattyú által végzett mechanikai munkává alakul át (6. csúszka).
6. Az UE tisztítása, visszaállítása „Üres” állapotba (7. dia). A ciklus befejeződött (8. dia = 1. dia).
Meglepő módon ez a paradoxon csak az 1980-as években oldódott meg. Ezalatt kiderült, hogy elvileg bármilyen folyamat visszafordíthatóvá tehető, pl. entrópiával történő „fizetés” nélkül. Végül Bennett 1982-ben megállapította a végső kapcsolatot e kijelentés és Maxwell paradoxona között. Azt javasolta, hogy a démon ténylegesen megtudja, hol van a molekula a Szilard motorban anélkül, hogy munkát végezne, vagy növelné a környezet entrópiáját (termosztát), és így egy motorciklus alatt hasznos munkát végezne. A molekula helyzetére vonatkozó információknak azonban a démon memóriájában kell maradniuk (psi.1). Ahogy egyre több ciklust hajtanak végre, egyre több információ halmozódik fel a memóriában. A termodinamikai ciklus befejezéséhez a démonnak törölnie kell a memóriában tárolt információkat. Ezt az információtörlési műveletet kell a környezet entrópiáját növelő folyamatnak minősíteni, amint azt a második elv megköveteli. Ezzel teljessé válik a Maxwell-démon eszközének alapvetően fizikai része.
Ezeknek az elképzeléseknek némi továbbfejlesztése D. D. Kadomtsev munkáiban kapott helyet.
Vegyünk egy ideális gázt, amely csak egy részecskéből áll (Kadomcev, "dinamika és információ"). Ez nem abszurd. Ha egy részecskét T hőmérsékletű falú V térfogatú edénybe zárunk, akkor előbb-utóbb ezekkel a falakkal egyensúlyba kerül. Az idő minden pillanatában a tér egy jól meghatározott pontjában és jól meghatározott sebességgel van. Az összes folyamatot olyan lassan hajtjuk végre, hogy a részecskének átlagosan lesz ideje kitölteni a teljes térfogatot, és ismételten megváltoztatni a sebesség nagyságát és irányát az edény falával való rugalmatlan ütközések során. Így a részecske átlagos nyomást gyakorol a falakra, hőmérséklete van T sebességeloszlása pedig Maxwell-féle a hőmérséklettel T. Ez az egy részecskéből álló rendszer adiabatikusan összenyomható, hőmérséklete változtatható, így lehetőség nyílik az edény falával egyensúlyba kerülni.
Átlagos nyomás a falon a N = 1 , egyenlő p= T/V, és az átlagos sűrűség n = 1/ V. Tekintsük az izoterm folyamat esetét, amikor T =const. Az első indítástól kezdve T =const. és p= T/V kapunk
![]() , mert a
, mert a
Ebből azt találjuk, hogy az entrópia változása nem függ a hőmérséklettől, tehát
![]()
Itt kerül bevezetésre az integráció állandója: „részecskeméret”< Működés izoterm folyamatban a munkát az entrópiák különbsége határozza meg. Tegyük fel, hogy vannak ideális válaszfalaink, amelyek segítségével az edényt energiafelhasználás nélkül részekre oszthatjuk. Az edényünket térfogattal két egyenlő részre osztjuk V/2
minden egyes. Ebben az esetben a részecske az egyik felében lesz – de nem tudjuk, melyikben. Tegyük fel, hogy van egy olyan eszközünk, amely lehetővé teszi annak meghatározását, hogy a részecske melyik részén található, például egy precíziós mérleg. Ekkor a két félben való lét 50% és 50% közötti szimmetrikus valószínűségi eloszlásából 100% valószínűséget kapunk az egyik félre - a valószínűségi eloszlás „összeomlása” következik be. Ennek megfelelően az új entrópia értékkel kisebb lesz, mint az eredeti entrópia Az entrópia csökkentésével munkát lehet végezni. Ehhez elég a partíciót az üres kötet felé mozgatni, amíg el nem tűnik. Egyenlő lesz a munka Ha a külvilágban semmi sem változott, akkor ezeknek a ciklusoknak a megismétlésével meg lehet építeni egy második típusú örökmozgót. Ez Maxwell démona Szilárd változatában. De a termodinamika második főtétele csak a hő miatt tiltja a munka átvételét. Tehát valaminek történnie kell a külvilágban. Mi ez? Részecske észlelése az egyik felében megváltoztatja a részecskével kapcsolatos információkat -
a két lehetséges fél közül csak az egyik van feltüntetve, amelyben a részecske található. Ez a tudás egy bitnyi információnak felel meg. A mérési folyamat csökkenti a részecske entrópiáját (átmenet egy nem egyensúlyi állapotba), és pontosan ugyanígy növeli a rendszerről (részecske) vonatkozó információt. Ha ismételten osztja a korábban kapott felek, negyedek, nyolcadok stb. felét, akkor az entrópia következetesen csökken, és az információ nő! Más szavakkal Minél többet ismerünk egy fizikai rendszerről, annál kisebb az entrópiája. Ha mindent tudunk a rendszerről, ez azt jelenti, hogy egy erősen nem egyensúlyi állapotba vittük át, amikor paraméterei a lehető legtávolabb vannak az egyensúlyi értékektől. Ha modellünkben a részecske a térfogat egységcellájába helyezhető V 0
, akkor ugyanakkor S = 0
, és az információ eléri maximális értékét Tehát az információs entrópia a fizikai rendszer aktuális állapotára vonatkozó információ hiányának (vagy bizonytalanságának mértékének) mértéke. Shannon információs entrópia: Információ mennyisége
én(vagy egyszerűen információ) egy klasszikus rendszer állapotáról, amelyet a vizsgált rendszerhez valamilyen kommunikációs csatornán keresztül csatlakoztatott külső eszköz által végzett mérések eredményeként nyernek, az információs entrópia különbségeként határozzuk meg, amely megfelel a rendszer kezdeti bizonytalanságának. rendszer állapota H 0
, valamint a rendszer mérés utáni végső állapotának információs entrópiája H. Ily módon én
+
H
=
H
0
=
const
.
Ideális esetben, ha a kommunikációs csatornában nincs külső forrás által keltett zaj és interferencia, a mérés utáni végső valószínűségi eloszlás egy meghatározott értékre csökken. p n= 1, azaz H =
0, és a mérés során nyert információ maximális értékét a következők határozzák meg:
Imax =
H 0
. Így a rendszer Shannon információs entrópiája a rendszerben található maximális információ jelentését jelenti; ideális körülmények között határozható meg a rendszer zaj- és interferenciamentes állapotának mérésére, amikor a végállapot entrópiája nulla: Tekintsünk egy klasszikus logikai elemet, amely a két egyenlő valószínűségű „0” és „1” logikai állapot egyikében lehet. Egy ilyen elem a környezettel - egy termosztáttal és egy külső hőszigetelt tárgy által generált jellel - egyetlen nem egyensúlyi zárt rendszert alkot. Egy elem átmenete az egyik állapotba, például a „0” állapotba, a stat csökkenésének felel meg. állapotának súlya a kezdeti állapothoz képest 2-szer (háromszintű rendszerek esetén 3-szor). Keressük a csökkenést információs entrópia Shannon, ami az elemre vonatkozó információ mennyiségének eggyel történő növekedésének felel meg, amit ún bit: Ezért az információs entrópia határozza meg a bitek számát, amelyek szükségesek az információ kódolásához a kérdéses rendszerben vagy üzenetben. IRODALOM 1. D. Landau, I. Lifshits. Statisztikai fizika. 1. rész Tudomány, M 1976. 2. M. A. Leontovics. Bevezetés a termodinamikába. Statisztikai fizika. Moszkva, Nauka, 1983. - 416. sz. 3. B. B. Kadomcev. Dinamika és információ. UFN, 164, No. 5, 449 (1994).![]() mert a valószínűsége pmin talál egy részecskét egy adott cellában egyenlő V 0
/
V. Ha a következő pillanatokban a részecske elkezd nagyobb térfogatot kitölteni, akkor az információ elveszik, és az entrópia megnő. Hangsúlyozzuk, hogy az információért (a második törvény szerint) az entrópia növelésével kell fizetni Se külső rendszer, és Valóban, ha egy bit információra az eszköz (külső rendszer) egy bitnél kisebb mértékben növeli az entrópiáját, akkor megfordíthatnánk a hőmotort. Ugyanis a részecske által elfoglalt térfogat bővítésével az entrópiáját a ln2
munkát szerezni Tln2
, és a részecske plusz eszközrendszer teljes entrópiája csökkenne. De ez a második törvény szerint lehetetlen. Formálisan,
mert a valószínűsége pmin talál egy részecskét egy adott cellában egyenlő V 0
/
V. Ha a következő pillanatokban a részecske elkezd nagyobb térfogatot kitölteni, akkor az információ elveszik, és az entrópia megnő. Hangsúlyozzuk, hogy az információért (a második törvény szerint) az entrópia növelésével kell fizetni Se külső rendszer, és Valóban, ha egy bit információra az eszköz (külső rendszer) egy bitnél kisebb mértékben növeli az entrópiáját, akkor megfordíthatnánk a hőmotort. Ugyanis a részecske által elfoglalt térfogat bővítésével az entrópiáját a ln2
munkát szerezni Tln2
, és a részecske plusz eszközrendszer teljes entrópiája csökkenne. De ez a második törvény szerint lehetetlen. Formálisan, ![]() , ezért a rendszer (részecske) entrópiájának csökkenése az eszköz entrópiájának növekedésével jár együtt.
, ezért a rendszer (részecske) entrópiájának csökkenése az eszköz entrópiájának növekedésével jár együtt.![]() , ahol (ez kétszintű rendszerekre vonatkozik, például bitekre: „0” és „1”. Ha a méret n, akkor H =
log n.
Igen, azért n
= 3, H =log 3
ráadásul = 3.)
, ahol (ez kétszintű rendszerekre vonatkozik, például bitekre: „0” és „1”. Ha a méret n, akkor H =
log n.
Igen, azért n
= 3, H =log 3
ráadásul = 3.)