Способы получения металлов. Виды сплавов
Существует несколько способов получения металлов в промышленности. Их применение зависит от химической активности получаемого элемента и используемого сырья. Некоторые металлы встречаются в природе в чистом виде, другие же требуют сложных технологических процедур для их выделения. Добыча одних элементов занимает несколько часов, другие же требуют многолетней обработки в особых условиях. Общие способы получения металлов можно разделить на следующие категории: восстановление, обжиг, электролиз, разложение.
Есть также специальные методы получения редчайших элементов, которые подразумевают создание специальных условий в среде обработки. Сюда может входить ионная декристаллизация структурной решетки или же наоборот, проведение контролируемого процесса поликристаллизации, которые позволяют получать определенный изотоп, радиоактивное облучение и другие нестандартные процедуры воздействия. Они используются довольно редко ввиду высокой дороговизны и отсутствия практического применения выделенных элементов. Поэтому остановимся подробнее на основных промышленных способах получения металлов. Они довольно разнообразны, но все основаны на использовании химических или физических свойств определенных веществ.
Основные способы получения металлов
Одним из основных способов получения металлов является их восстановление из оксидов. Это одно из самых распространенных соединений металлов, которые встречаются в природе. Процесс восстановления протекает в доменных печах под воздействием высоких температур и при участии металлических или неметаллических восстановителей. Из металлов используют элементы с высокой химической активностью, например, кальций, магний, алюминий.
Среди неметаллических веществ применяются оксид углерода, водород и коксующиеся угли. Суть процедуры восстановления заключается в том, что более активный химический элемент или соединение вытесняет металл из оксида и вступает в реакцию с кислородом. Таким образом, на выходе образуется новый оксид и чистый металл. Это самый распространенный способ получения металлов в современной металлургии.
Обжиг является лишь промежуточным методом получения чистого элемента. Он предполагает сжигание сульфида металла в кислородной среде, в результате чего образуется оксид, который затем подвергается процедуре восстановления. Этот метод также применяется довольно часто, так как сульфидные соединения широко распространены в природе. Прямое получение чистого металла из его соединений серой не используют по причине сложности и дороговизны технологического процесса. Гораздо проще и быстрее провести двойную обработку, как было указано выше.
Электролиз, как способ получения металлов подразумевает пропускание тока через расплав металлического соединения. В результате процедуры чистый металл оседает на катоде, а остальные вещества - на аноде. Такой способ применим к солям металлов. Но он не является универсальным для всех элементов. Подходит способ для получения щелочных металлов и алюминия. Это связано с их высокой химической активностью, которая под воздействием электрического тока позволяет с легкостью нарушать установленные в соединениях связи. Иногда электролитический способ получения металлов применяют к щелочноземельным элементам, но они уже не так хорошо поддаются данной обработке, а некоторые и вовсе не разрывают полностью связь с неметаллом.

Последний способ - разложение происходит под воздействием высоких температур, которые позволяют разорвать связи между элементами на молекулярном уровне. Для каждого соединения потребуется свой температурный уровень, но в целом метод не содержит каких-либо хитростей или особенностей. Единственный момент: полученный в результате обработки металл, может потребовать проведения процедуры спекания. Но этот способ позволяет получить практически на 100% чистый продукт, так как для его проведения не применяются катализаторы и другие химические вещества. В металлургии способы получения металлов называют пирометаллургическим, гидрометаллургическим, электрометаллургическим и термическим разложением. Это четыре приведенных выше способа, только названные не по химической, а по промышленной терминологии.
Как получают металл в промышленности
Способ производства металла во многом зависит от его распространения в недрах земли. Добыча в основном происходит в виде руды с определенным процентным содержанием элементов. Богатые руды могут содержать до 90% металла. Бедные руды, которые содержат всего 20-30% вещества, перед обработкой отправляют на обогатительную фабрику.
В чистом виде в природе встречаются только благородные металлы, которые добывают в виде самородков различного размера. Химически активные элементы встречаются либо в виде простых солей, либо в виде полиэлементных соединений, которые имеют очень сложное химическое строение, но в основном достаточно просто разлагаются на составляющие при определенном воздействии. Металлы средней и малой активности в природных условиях образуют оксиды и сульфиды. Реже их можно встретить в составе сложных кислотно-металлических соединений.

Перед получением чистого металла зачастую производится одна или несколько процедур разложения сложных веществ на более простые. Гораздо проще выделять один продукт из двухэлементного соединения, чем из многоэлементного сложного образования. К тому же технологический процесс требует тщательного контроля, который очень сложно обеспечить, когда речь идет о большом количестве примесей с разными свойствами.

Что касается экологической стороны вопроса, то самым чистым можно признать электрохимический способ получения металлов, так как при его проведении в атмосферу не выделяется никаких веществ. В остальном же металлургия является одним из самых вредных для природы производств, поэтому в современном мире уделяется большое внимание проблеме создания безотходного оборудования.

Уже сейчас многие заводы отказались от использования мартеновских печей в пользу более современных электрических моделей. Они потребляют гораздо больше энергии, но не выбрасывают в атмосферу продукты сгорания топлива. Очень важной является и вторичная переработка металлов. Для этого во всех странах оборудованы специальные пункты приема, в которых можно сдавать вышедшие из эксплуатации детали из черных и цветных металлов, которые затем отправятся на переработку. В будущем из них изготовят новую продукцию, которую можно будет использовать в соответствии с назначением.
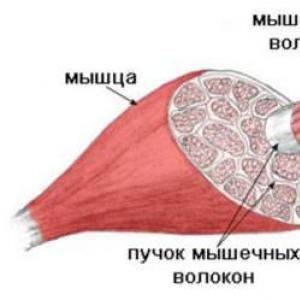
Металлы в природе могут находиться в виде минералов, горных пород, водных растворов. Только немногие (Au, Pt, отчасти Ag, Cu, Hg) встречаются в свободном состоянии.
Минерал – индивидуальное вещество с определенной кристаллической структурой (например, мел, мрамор – это карбонат кальция). Горная порода – смесь минералов. Горная порода, содержащая значительное количество металлов, называется рудой. Водные растворы – океанская и морская вода; минеральная вода (в растворах металлы находятся в виде солей).
Металлургия – это наука, которая изучает и разрабатывает промышленные методы получения металлов из руд.
Перед тем, как получать металлы, руду обогащают (концентрируют), т. е. отделяют от пустой породы.
Существуют различные способы обогащения руд. Чаще всего применяется флотационный, гравитационный и магнитный способы.
Например, содержание меди в эксплуатируемых рудах обычно не превышает 1 %, поэтому необходимо предварительное обогащение. Оно достигается применением метода флотации руд, основанного на различных адсорбционных свойствах поверхностей частиц сернистых металлов и окружающей их пустой породы силикатного типа. Если в воде, содержащей небольшую примесь малополярного органического вещества (например, соснового масла), взболтать порошок тонко измельченной медной руды и сквозь всю систему продувать воздух, то частицы сернистой меди будут вместе с воздушными пузырьками подниматься вверх и перетекать через край сосуда в виде пены, а частицы силикатов осядут на дно. На этом основан флотационный метод обогащения, при помощи которого ежегодно перерабатывается более 100 млн т сернистых руд различных металлов. Обогащенная руда – концентрат – содержит обычно от 20 до 30 % меди. При помощи селективной (избирательной) флотации удается не только отделять руду от пустой породы, но и разделять отдельные минералы полиметаллических руд.
Металлургические процессы разделяют на пирометаллургические и гидрометаллургические.
Пирометаллургия – восстановление металлов из их соединений (оксидов, сульфидов и др.) в безводных условиях при высоких температурах.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига, а затем восстанавливают оксиды углем или СО:
ZnS + 3O 2 = 2 ZnO + 2SO 2 ; 2PbS + 3O 2 = 2 PbO + 2SO 2 ;
ZnO + C = Zn + CO; PbO + C = Pb + CO.
Пирометаллургическим способом получают, например, чугун и сталь.
Однако не все металлы можно получить восстановлением их оксидов углем или СО, поэтому применяют более сильные восстановители: водород, магний, алюминий, кремний. Например, такие металлы, как хром, молибден, железо получают алюминотермией :
3Fe 3 O 4 + 8Al = 9Fe + 4Al 2 O 3 .
Гидрометаллургия – извлечение металлов из руд с помощью водных растворов тех или иных реагентов.
Например, руду, содержащую основную соль (CuOH) 2 CO 3 , обрабатывают раствором серной кислоты:
(CuOH) 2 CO 3 + 2H 2 SO 4 = 2CuSO 4 + 3H 2 O + CO 2 .
Из полученного раствора сульфата медь выделяют либо электролизом, либо действием металлического железа:
Fe + CuSO 4 = Cu + FeSO 4 .
Вытеснение одного металла другим из раствора его соли называется в технике цементацией.
Медь, цинк, кадмий, никель, кобальт, марганец и другие металлы получают электролизом растворов солей. Разряд ионов металла из растворов происходит на катоде:
Cu +2 + 2е – = Cu 0 .
В этих процессах используют нерастворимые аноды, на которых обычно выделяется кислород:
2H 2 O – 4е – → O 2 + 4H + .
Активные металлы (щелочные и щелочноземельные) получают электролизом расплавов, так как в воде эти металлы растворимы:
(катод, –): Mg +2 + 2е – = Mg 0 ; (анод, +): 2Cl – – 2е – = Cl 2 0 .
Способы очистки металлов
Свойства металлов зависят от содержания в них примесей. Например, титан долгое время не находил применения из-за хрупкости, обусловленной наличием примесей. После освоения методов очистки применение титана резко возросло. Особенно большое значение имеет чистота материалов в электронной, вычислительной технике и ядерной энергетике.
Рафинирование – процесс очистки металлов, основанный на различии физических и химических свойств металла и примесей.
Все методы очистки металлов можно разделить на химические и физико-химические.
Химические методы очистки заключаются во взаимодействии металлов с теми или иными реагентами, образующими с основными металлами или примесями осадки или газообразные продукты. Для получения высокочистых никеля, железа, титана применяется термическое разложение летучих соединений металла (карбоксильный процесс, иодидный процесс).
Рассмотрим, например, получение циркония. В замкнутой системе находятся пары йода и сырой цирконий. Температура в реакционном сосуде 300 ºС. При этой температуре на поверхности циркония образуется летучий тетраиодид циркония:
Zr (тв)+ 2I 2 (г) ↔ ZrI 4 (г).
В реакционном сосуде находится вольфрамовая нить, раскаленная до 1500 ºС. За счет высокой обратимости данной реакции иодид циркония осаждается на вольфрамовой нити и разлагается с образованием циркония.
Физико-химические методы включают в себя электрохимические, дистилляционные, кристаллизационные и другие способы очистки.
В металлургии легких и цветных металлов широко используется электролиз. Этот метод используют для очистки многих металлов: меди, серебра, золота, свинца, олова и др.
Рассмотрим, например, рафинирование черного никеля, содержащего примеси цинка и меди и служащего анодом в электролизере:
Е 0 Zn 2+ / Zn = – 0,76 В; Е 0 Cu 2+ / Cu = ,34 В; Е 0 Ni 2+ / Ni = – 0,25 В.
На аноде в первую очередь растворяется металл с наиболее отрицательным потенциалом. Так как
Е 0 Zn 2+ / Zn < Е 0 Ni 2+ / Ni < Е 0 Cu 2+ / Cu ,
то первым растворяется цинк, а затем основной металл – никель:
Zn – 2e – → Zn 2 + , Ni – 2e – → Ni 2 + .
Примесь меди, имеющая более положительный потенциал, не растворяется и выпадает в осадок (шлам) в виде частиц металла. В растворе окажутся ионы Zn 2+ и Ni 2+ . На катоде в первую очередь осаждается металл с наиболее положительным потенциалом, т. е. никель. Таким образом, в результате рафинирования никель осаждается на катоде, медь выпадает в шлам, а цинк переходит в раствор.
Электролизом расплавов соединений получают алюминий, магний, натрий, литий, бериллий, кальций, а также сплавы некоторых металлов. К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора NaCl с получением газообразных хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве. Кроме того, электролизом получают фтор из расплава смеси HF и NaF, водород и кислород из воды (для снижения омических потерь электролиз ведут в растворе NaOH), диоксид марганца из раствора MnSO 4 и т. д.
Широко применяют зонную плавку , заключающуюся в том, что вдоль слитка (стержня) медленно перемещается зона нагрева и соответственно зона расплавленного металла. Некоторые примеси концентрируются в расплаве и собираются в конце слитка, другие – в начале слитка. После многократных прогонов отрезают начальную и конечную части слитка, остается очищенная средняя часть металла.
Сплавы металлов
Сплав – это система с металлическими свойствами, состоящая из двух или более металлов (один компонент может быть неметаллом).
Вопросы химического взаимодействия металлов между собой, а также с неметаллами, если продукты их взаимодействия сохраняют металлические свойства, изучает один из разделов неорганической химии – металлохимия .
Если расположить металлы в порядке усиления их химического взаимодействия друг с другом, то получится следующий ряд:
– компоненты не взаимодействуют друг с другом ни в жидком, ни в твердом состоянии;
– компоненты взаимно растворяются в жидком состоянии, а в твердом состоянии образуют эвтектику (механическая смесь );
– компоненты образуют друг с другом жидкие и твердые растворы любого состава (системы с неограниченной растворимостью );
– компоненты образуют между собой одно или несколько металлических соединений, называемых интерметаллическими (система с образованием химического соединения ).
Для изучения физических свойств сплавов в зависимости от их состава широко используют физико-химический анализ. Это позволяет обнаружить и изучить происходящие в системе химические изменения.
О химических превращениях в системе можно судить по характеру изменения разнообразных физических свойств – температур плавления и кристаллизации, давления пара, вязкости, плотности, твердости, магнитных свойств, электрической проводимости системы в зависимости от ее состава. Из различных видов физико-химического анализа более часто применяют термический анализ . В ходе анализа строят и изучают диаграммы плавкости, которые представляют собой график зависимости температуры плавления системы от ее состава.
Чтобы построить диаграмму плавкости, берут два чистых вещества и готовят из них смеси различного состава. Каждую смесь расплавляют и затем медленно охлаждают, отмечая через определенные промежутки времени температуру остывающего сплава. Таким образом получают кривую охлаждения. На рис. 1. приведены кривые охлаждения чистого вещества (1) и сплава (2 ). Переход чистого вещества из жидкого в твердое состояние сопровождается выделением теплоты кристаллизации, поэтому, пока вся жидкость не закристаллизуется, температура остается постоянной (участок bс, кривая 1 ). Далее охлаждение твердого вещества идет равномерно.
При охлаждении расплава (раствора) кривая охлаждения имеет более сложный вид (рис. 1, кривая 2). В простейшем случае охлаждения расплава двух веществ вначале происходит равномерное понижение температуры, пока из раствора не начинают выделяться кристаллы одного из веществ. Так как температура кристаллизации раствора ниже, чем чистого растворителя, то кристаллизация одного из веществ из раствора начинается выше температуры кристаллизации раствора. При выделении кристаллов одного из веществ состав жидкого расплава изменяется, и температура его затвердевания непрерывно понижается по мере кристаллизации. Выделяющаяся при кристаллизации теплота несколько замедляет ход охлаждения и поэтому, начиная с точки l на кривой 2, крутизна линии кривой охлаждения уменьшается. Наконец, когда расплав делается насыщенным относительно обоих веществ, начинается кристаллизация обоих веществ одновременно. Это отвечает появлению на кривой охлаждения горизонтального участка b`с`. Когда кристаллизация заканчивается, наблюдается дальнейшее падение температуры.
На основании кривых охлаждения смесей разного состава строят диаграмму плавкости. Рассмотрим наиболее типичные из них.
Похожая информация.
Урок №26.
Тема: Общие способы получения металлов.
Цель урока: повторить и систематизировать сведения об основных способах получения металлов в промышленности.
Задачи:
ОБУЧАЮЩИЕ
обеспечить усвоение понятий об основных способах получения металлов: пирометаллургии, гидрометаллургии и электрометаллургии;
Рассмотреть и сравнить различные способы получения металлов из природного сырья.
Рассмотреть сущность электролиза, особенности электролиза растворов электролитов.
Закрепить умение составлять окислительно-восстановительные реакции.
РАЗВИВАЮЩИЕ
развивать умение логически мыслить,
анализировать, делать обобщения и выводы,
проводить сравнения;
ВОСПИТЫВАЮЩИЕ
воспитывать умение находить главное,
способствовать развитию интереса к учебе.
Тип урока : комбинированный.
Оборудование и материалы:
раздаточный дидактический материал;
мультимедиопроектор;
презентация.
Ход урока.
I. Организационный этап.
Приветствие. Проверка готовности к уроку.
II. Повторение изученного материала.
Проведение самостоятельной работы.
III. Изучение нового материала.
1. Металлы в природе. Металлургия.
Только в свободном виде встречаются золото и платина. И в самородном виде, и в форме соединений могут находиться в природе серебро, медь, ртуть и олово. Все остальные металлы, которые находятся в ряду напряжения до Sn , встречаются в природе только в виде соединений.
Среди таких соединений:
хлориды (сильвин, галит, или каменная соль, сильвинит);
нитраты (чилийская селитра);
сульфаты (глауберова соль, гипс);
карбонаты (мел, мрамор, известняк; магнезит, доломит);
силикаты, в том числе содержащие алюминий – алюмосиликаты (белая глина, или каолин, полевые шпаты, слюда);
сульфиды (серный колчедан, киноварь, цинковая обманка);
фосфаты.
Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами.
Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими. Например, медно-молибденовые, свинцово-серебрянные и т. д.
Металлургия – это отрасль промышленности, которая занимается получением металлов из руд. Так же называется и наука о промышленных способах получения металлов из руд.
2. Общие способы получения металлов.
1) Пирометаллургия – восстановление металлов из руд при высоких температурах с помощью восстановителей (углерода, оксида углерода (II), водорода, металлов – алюминия, магния).
Показ видеосюжета – получение меди из его оксида с помощью восстановителя – водорода.
Показ видеосюжета – получение свинца из его оксида с помощью восстановителя угля.
Напишите уравнение этой реакции.
Показ видеосюжета – получение хрома алюмотермией.
Напишите уравнение этой реакции.
2) Гидрометаллургия - восстановление более активными металлами менее активных из растворов их солей.
Это получение металлов, которое проходит в два этапа:
Природное соединение «растворяют» в подходящем реагенте с целью получения раствора соли этого металла.
Из образовавшегося раствора данный металл вытесняют более активным металлом или восстанавливают электролизом.
Например, для получения меди из руды, содержащей оксид меди (II) CuO:
С uO + H 2 SO 4 = CuSO 4 + H 2 O
CuSO 4 + Fe = FeSO 4 + Cu
Таким же способом получают серебро, цинк, молибден, золото, уран и т. д.
3) Электрометаллургия - это способы получения металлов с помощью электрического тока (электролиза).
Давайте вспомним, что такое: электролиз, электролит, электрод, катод, анод, катионы, анионы.
При электролизе окислителем и восстановителем является электрический ток.
Процессы окисления и восстановления разделены в пространстве, они совершаются не при контакте частиц друг с другом, а при соприкосновении с электродами электрической цепи.
3. Электролиз водных растворов электролитьв.
Катодные процессы в водных растворах электролитов: катионы или молекулы воды принимают электронов и восстанавливаются.
1. Катионы металлов со стандартным электродным потенциалом, большим, чем у ВОДОРОДА, расположены в ряду напряжений после него: Cu 2+ , Hg 2+ , Ag+, Pt 2+ , ..., до Pt 4+ . При электролизе они почти полностью восстанавливаются на катоде и выделяются в виде металла.
2H 2 O + 2e - = H 2 + 2OH -
2. Катионы металлов с малой величиной стандартного электродного потенциала (катионы металлов начала ряда напряжений Li + , Na + , K + , Rb + , ..., до Al 3+ включительно). При электролизе на катоде они не восстанавливаются, вместо них восстанавливаются молекулы воды.
2H 2 O + 2e - = H 2 + 2OH -
3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у ВОДОРОДА, но большим, чем у алюминия (Mn 2+ , Zn 2+ , Cr 3+ , Fe 2+ , ..., до H). При электролизе эти катионы, характеризующиеся средними величинами электроноакцепторной способности, на катоде восстанавливаются одновременно с молекулами воды.
Zn 2+ + 2e = Zn0
2H 2 O + 2e - = H 2 + 2OH -
Рассмотрим электролиз расплава и раствора хлорида натрия.
Посмотрим видеофрагмент - электролиз раствора хлорида меди (II).
Напишите уравнение этой реакции.
IV. Закрепление изученного материала
Просмотр видео-фрагмета (эл.приложение к учебнику)к п.26
п.26 стр.123 (тесты)
V. Заключение.
Давайте подведем итоги сегодняшнего урока.
Анализ личного результата (стр.123)
VI. Домашнее задание.
п. 26 стр.122-123 задание1-3 (устно)
Индив. задание: 3 ученика (стр.123 задание 7).
Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления, значит для того, чтобы их получить, в виде простого вещества, необходимо провести процесс восстановления.
Но прежде чем восстановить природное соединение металла, необходимо перевести его в форму, доступную для переработки, например, оксидную форму с последующим восстановлением металла. На этом основан пирометаллургический способ. Это восстановление металлов из их руд при высоких температурах с помощью восстановителей неметаллических? кокс, оксид углерода (II), водород; металлических? алюминий, магний, кальций и другие металлы. .
Демонстрационный опыт 1. Получение меди из оксида с помощью водорода.
Cu +2O + H2 = Cu0 + H2O (водородотермия)
Демонстрационный опыт 2. Получение железа из оксида с помощью алюминия.
Fe+32O3 +2Al = 2Fe0 + Al2O3 (алюмотермия)
Для получения железа в промышленности железную руду подвергают магнитному обогащению:3Fe2 O3 + H2 = 2Fe3O4 + H2O или 3Fe2O3 + CO = 2Fe3O4 + CO2 , а затем в вертикальной печи проходит процесс восстановления:
Fe3O4 + 4H2 = 3Fe + 4H2O
Fe3O4 + 4CO = 3Fe + 4CO2
Просмотр медиалекции. (CD)
Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте:
CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения
CuSO4 + Fe = FeSO4 + Cu.
Демонстрационный опыт 3. Взаимодействие железа с раствором медного купороса.
Таким способом получают серебро, цинк, молибден, золото, ванадий и другие металлы.
Электрометаллургический способ.
Это способы получения металлов с помощью электрического тока (электролиза). Просмотр фрагмента медиалекции. (CD)
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl -> Na+ + Cl?
катод Na+ + e > Na0 ¦ 2
анод 2Cl? ?2e > Cl20 ¦ 1
суммарное уравнение: 2NaCl = 2Na + Cl2
Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия? электролитом.
Al2O3 -> AlAlO3 -> Al3+ + AlO33–
катод Al3+ +3e -> Al 0 ¦ 4
анод 4AlO33– – 12 e -> 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3= 4Al + 3O2 .
Термическое разложение соединений.
Железо взаимодействует с оксидом углерода (II) при повышенном давлении и температуре 100-2000, образуя пентакарбонил: Fe + 5CO = Fe (CO)5
Пентакарбонил железа-жидкость, которую можно легко отделить от примесей перегонкой. При температуре около 2500 карбонил разлагается, образуя порошок железа: Fe (CO)5 = Fe + 5CO.
Металлы находятся в природе преимущественно в виде соединений. Только металлы с малой химической активностью (благородные металлы) встречаются в природе в свободном состоянии (платиновые металлы, золото, медь, серебро, ртуть). Из конструкционных металлов в достаточном количестве имеются в природе в виде соединений лишь железо, алюминий, магний. Они образуют мощные залежи месторождений относительно богатых руд. Это облегчает их добычу в больших масштабах.
Поскольку металлы в соединениях находятся в окисленном состоянии (имеют положительную степень окисления), то получение их в свободном состоянии сводится к процессу восстановления:
Этот процесс можно осуществить химическим или электрохимическим путем.
При химическом восстановлении в качестве восстановителя чаще всего применяют уголь или оксид углерода (II), а также водород, активные металлы, кремний. С помощью оксида углерода (II) получают железо (в доменном процессе), многие цветные металлы (олово, свинец, цинк и др.):
![]()
Восстановление водородом используется, например, для получения вольфрама из оксида вольфрама (VI):
Применение в качестве восстановителя водорода обеспечивает наибольшую чистоту получаемого металла. Водород используют для получения очень чистого железа, меди, никеля и других металлов.
Способ получения металлов, в котором в качестве восстановителя применяют металлы, называют металлотермическим . В этом способе в качестве восстановителя используют активные металлы. Примеры металлотермических реакций:
алюминотермия:
магниетермия:
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Металлы наиболее часто получают восстановлением их оксидов, которые в свою очередь выделяют из соответствующей природной руды. Если исходной рудой являются сульфидные минералы, то последние подвергают окислительному обжигу например:
Электрохимическое получение металлов осуществляется при электролизе расплавов соответствующих соединений. Таким путем получают наиболее активные металлы, щелочные и щелочноземельные металлы, алюминий, магний.
Электрохимическое восстановление применяют также для рафинирования (очистки) «сырых» металлов (меди, никеля, цинка и др.), полученных другими способами. При электролитическом рафинировании в качестве анода используют «черновой» (с примесями) металл, в качестве электролита - раствор соединений данного металла.
Способы получения металлов, осуществляемые при высоких температурах, называют пирометаллургическими (по-гречески pyr - огонь). Многие из этих способов известны с древних времен. На рубеже XIX-XX вв. начинают развиваться гидрометаллургические способы получения металлов (по-гречески hydor-вода). При этих способах компоненты руды переводят в водный раствор и далее выделяют металл электролитическим или химическим восстановлением. Так получают, например, медь. Медную руду, содержащую оксид меди (II) CuО, обрабатывают разбавленной серной кислотой:
Для восстановления меди полученный раствор сульфата меди (II) либо подвергают электролизу, либо действуют на раствор порошком железа.
Гидрометаллургический способ имеет большое будущее, так как позволяет получать продукт, не извлекая руду из земли. (Сравните достоинства гидрометаллургического способа получения металлов с подземной газификацией угля.)